Formato pdf
Fecha de publicación: 7/5/2020
Información dirigida a profesionales sanitarios
ÍNDICE
- Introducción
- Notificaciones individuales de sospechas de acontecimeinetos adversos (AA)
- Informes periódicos de seguridad (IPS) y estudios posautorizacion
- Procedimientos centralizados, descentralizados y de reconocimeinto mutuo
- Comité de seguridad de medicamentos veterinaniors (CSMV)
- Comité técnico del sistema español de farmacovigilancia de medicamentos veterinarios (CTSEF-VET)
- Alertas e informaciones de seguridad no urgente (NUIS) por razones de farmacovigilancia
- Alertas por defectos de calidad
- Promoción de la farmacovigilancia veterinaria
- Participación en reuniones internacionales
- Otras actividades
Introducción
Pese a la extensa información provista para garantizar la calidad, seguridad y eficacia durante la solicitud de registro solo es posible contar con un conocimiento completo del comportamiento de los medicamentos veterinarios una vez que se han registrado. Es en estas condiciones reales de uso, en las que el medicamento veterinario (MV) se administra en ocasiones a especies animales de destino no autorizadas (en base a los preceptos legales de prescripción excepcional), se utiliza en las diferentes razas de cada especie, en diversas condiciones de manejo, a animales con patologías concomitantes o que reciben tratamientos con más de un medicamento
(circunstancia bastante común en el ámbito veterinario), etc., cuando pueden aparecer problemas de eficacia o de seguridad novedosos que pueden ser relevantes. Por otra parte, una vez registrado el MV su uso normalmente alcanza a miles de animales, y solo entonces pueden dar la cara reacciones que tengan una incidencia muy baja y que no se han observado en los estudios preclínicos y clínicos.
Es aquí donde cobra importancia la actividad de Salud Pública que tienen por objeto la identificación, cuantificación, evaluación y prevención de los riesgos del uso de los medicamentos una vez comercializados, permitiendo así el seguimiento de los posibles efectos adversos de los medicamentos, o lo que es lo mismo, Farmacovigilancia (Real Decreto Legislativo 1/2015, de Garantías y Uso Racional de Medicamentos y Productos Sanitarios, Art. 53), y es por ello que se creó el Sistema Español de Farmacovigilancia de Medicamentos Veterinarios (mediante el Real Decreto 1275/2011) buscando confirmar si el balance beneficio/riesgo (B/R) del uso de los medicamentos veterinarios (MV) se mantiene dentro de los márgenes conocidos cuando se autorizó su comercialización, identificando si hay nuevos riesgos o si la gravedad y/o frecuencia de los riesgos ya conocidos ha variado significativamente y, en base a ello, instaurar medidas para evitar o minimizar sus consecuencias y poder así gestionar adecuadamente los riesgos para la salud pública, la sanidad animal y el medio ambiente.
Para el funcionamiento de este sistema es imprescindible la participación activa de los profesionales sanitarios, muy especialmente de los veterinarios, dado que se nutre de las notificaciones realizadas por los mismos.
Es importante recordar que el hecho de que se observen acontecimientos adversos a un MV no debe ser considerado como algo extraordinario, ya que no hay ningún MV que sea totalmente inocuo o exento de poder causar reacciones, ni ningún MV que sea 100% eficaz. De ahí la necesidad de implementar un sistema de FV y una evaluación técnica del balance B/R, para aportar a todos los interesados (profesionales sanitarios, ganaderos, propietarios de los animales y usuarios en general) la mejor información que ayude a tomar las mejores decisiones de tratamiento en cada momento.
Conforme establece la legislación europea, la FV cubre toda una serie de situaciones (más amplias que las que se contemplan en la farmacovigilancia de medicamentos de uso humano), incluyendo aspectos de seguridad y eficacia en los animales de destino, de seguridad en las personas que manipulan los MV o que entran en contacto con los animales a los que se les ha administrado el MV, en los consumidores de alimentos de origen animal (los problemas derivados de unos residuos mayores que los Límites Máximos de Residuos (LMR) aprobados en la UE) con las consiguientes repercusiones en la salud pública, así como problemas medioambientales. De forma global, pueden considerarse como sospechas de acontecimientos adversos (AA) los siguientes casos:
- Sospechas de reacciones adversas (RA) en animales en condiciones normales de empleo del MV, es decir, cuando su empleo es conforme con su autorización de comercialización y, por tanto, en línea con lo establecido en la ficha técnica
- RA tras el uso no contemplado, siendo éste el que corresponde a cualquier variación respecto a lo establecido en la autorización del MV.
- Sospecha de falta de la eficacia esperada.
- Insuficiencia de los tiempos de espera. La responsabilidad de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) es garantizar que si se respeta el tiempo de espera fijado en la autorización no aparecerán residuos por encima de los LMR en los alimentos de origen animal obtenidos de los animales tratados. De no ser así, se podría solicitar al titular de autorización de comercialización (en adelante, el titular) la correspondiente variación para aumentar el tiempo de espera.
- Reacciones en personas, que se pueden producir durante la administración del producto a los animales, contacto con el mismo, inyecciones accidentales, etc.
- Problemas medioambientales, consecuencia de los tratamientos administrados a los animales, y por último
- Transmisión de agentes infecciosos consecuencia de tratamientos con MV.
Notificaciones individuales de sospechas de acontecimeinetos adversos (AA)
La notificación o comunicación de un AA a un MV es obligatoria conforme la legislación nacional tanto para los profesionales sanitarios como para los Titulares. Para armonizar y simplificar estas notificaciones en la UE, la red de agencias europeas de MV elaboró dos formularios, uno de uso por profesionales sanitarios ( dos formularios) y otro para los Titulares, que están disponibles
en la web de la AEMPS ( web de la AEMPS. ). Complementariamente, la AEMPS ha editado
en papel el formulario de uso por profesionales sanitarios, conocido como Tarjeta Verde, y que ya viene preparado para su envío directo a la AEMPS y para ser franqueada en destino. Con independencia de lo anterior, ambos formularios se han incorporado a la base de datos nacional de FV (VIGÍA-VET), a la que tienen acceso los titulares y los profesionales sanitarios a través de Internet, previo registro.
La AEMPS recibe los AA de los titulares, de los profesionales sanitarios y de los ganaderos y propietarios de los animales, bien electrónicamente (a través de VIGÍA-VET o de la base de datos europea conocida como Eudravigilance Veterinaria (EVVET)) o bien en soporte papel (admisible para todos ellos pero solo en circunstancias excepcionales permitido para la industria). Además se ha facilitado un módulo en la aplicación de prescripción del Consejo General de Colegios Veterinarios (Prescrivet) así como en la aplicación del Consejo General de Colegios de Veterinarios de Andalucía (Recevet), para poder notificar estos casos directamente desde el móvil.
El número de notificaciones de AA en España en 2019 alcanzó las 2.078. De ellas, 1.579 AA fueron casos notificados por primera vez, y el resto seguimientos que aportaban una mayor información sobre casos notificados previamente.
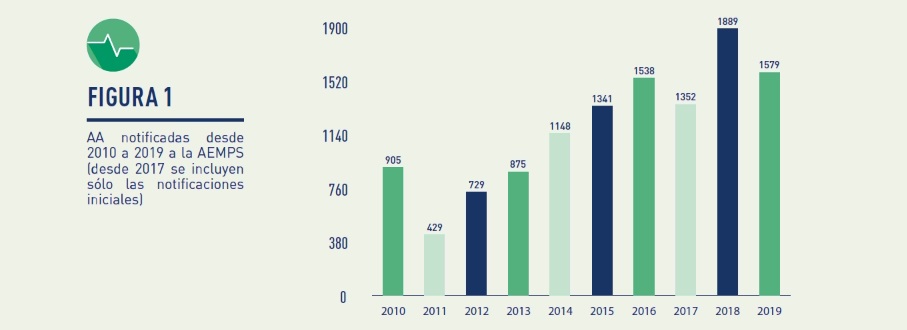
 En cuanto a la estratificación de estos acontecimientos adversos en el año 2019:
En cuanto a la estratificación de estos acontecimientos adversos en el año 2019:
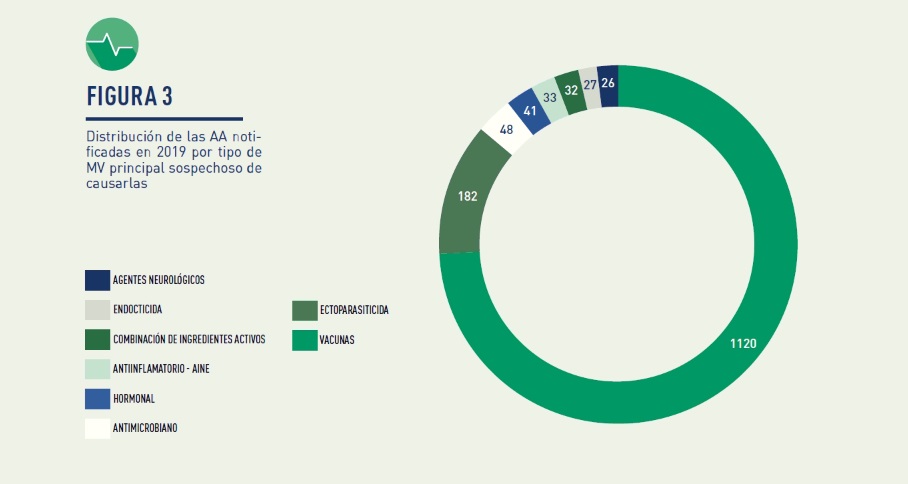

 En cuanto a la estratificación de estos acontecimientos adversos en el año 2019:
En cuanto a la estratificación de estos acontecimientos adversos en el año 2019:
- Las especies de destino en que se presentaron los AA fueron las siguientes: perro, gato, vaca, cerdo, oveja, cabra, conejo, pollo, caballo, abeja, hurón, pavo, rata y lubina.
- 24 casos afectaron a personas, habiéndose recibido 4 informes de seguimiento de las mismas.
- Medicamentos veterinarios implicados. Los grupos en los que más frecuentemente se ha notificado corresponden a: vacunas, ectoparasiticidas, antimicrobianos, hormonales, antiinflamatorios no esteroideos, endocticidas y agentes neurológicos.

- Respecto del origen de las notificaciones iniciales, en 2019 de nuevo fue mayoritaria la realizada por los titulares (1.510 AA, un 95,63%) frente al resto de posibles orígenes (profesionales sanitarios, ganaderos, propietarios de animales, otros usuarios, etc.), que notificaron (69 AA) el 4,36%.
- Conforme se establece en la normativa europea, la AEMPS ha enviado todas las AA notificados en España a EVVET.
Informes periódicos de seguridad (IPS) y estudios posautorizacion
La legislación europea establece una serie de obligaciones en materia de FV a los Titulares y entre ellas cabe destacar la de presentar con una determinada periodicidad informes periódicos con toda la información de seguridad a nivel mundial de todos sus MV. La frecuencia de envío de estos IPS depende del conocimiento previo que se disponga del medicamento o las sustancias activas incluidas en el mismo, siendo más frecuentes en medicamentos más novedosos. En total en 2019 se recibieron 1.477.
En la evaluación de los mismos merece destacar el papel desempeñado por la AEMPS en la evaluación de IPS en el programa Worksharing aprobado por los Jefes de Agencias (HMA), que tiene por objeto armonizar las fechas de presentación de los IPS de los MV, así como distribuir la responsabilidad de su evaluación entre las agencias reguladoras de todos los Estados miembros. De esta forma, para cada una de las sustancias incluidas en el programa, se elige un país como responsable (P-RMS), que será el encargado de elaborar los informes de evaluación y consensuar las decisiones con el resto de agencias (P-CMS). Hay que saber que, una vez adoptado el informe final no acaba el trabajo de las agencias, pues en ese preciso momento se inicia la «fase nacional» en la que cada agencia decide si, a la luz del informe final y de la información crítica de seguridad expresada por el titular (la conocida como Core Safety Data Sheet), se debe modificar la autorización de comercialización para introducir cambios en la Ficha Técnica, prospecto y etiquetado.
En 2019 se recibieron en el marco del Worksharing un total de 324 IPS, habiendo actuado España como P-RMS para 5 principios activos (metergolina, cefalonio, carnidazol, netobimina y melatonina).
Tras su evaluación y, en su caso, previo dictamen del Comité de Seguridad de Medicamentos Veterinarios (CSMV), en 47 de los IPS se concluyó que era necesario proceder a la modificación de las Fichas Técnicas.
Procedimientos centralizados, descentralizados y de reconocimeinto mutuo
En el año 2019 se elaboraron los siguientes informes actuando como Estado Miembro de Referencia o país Ponente:
- IPS: ascendieron a 44 de reconocimiento mutuo, 96 a descentralizado y 13 a centralizado.
Comité de seguridad de medicamentos veterinaniors (CSMV)
El CSMV es el órgano colegiado de la AEMPS creado para el asesoramiento técnico y científico en todo lo relativo a farmacovigilancia de los medicamentos veterinarios.
En 2019 se celebraron dos reuniones en las que se trató la modificación de la autorización de comercialización de 40 medicamentos veterinarios. Como en el caso de los demás comités de la AEMPS se publicaron en la web las correspondientes notas informativas de las reuniones celebradas.
Los dictámenes del CSMV y los cambios acordados en procedimientos de reconocimiento mutuo, descentralizado y de renovaciones de autorizaciones de comercialización que fueron sometidos a evaluación del CSMV, fueron los siguientes (hay que tener en cuenta que algunos de los dictámenes iniciales acordados pueden sufrir alguna modificación durante el procedimiento administrativo de implementación, ya que los titulares disponen de un plazo para realizar las alegaciones que estimen conveniente y, del estudio de estas alegaciones, pueden derivarse cambios en las modificaciones inicialmente acordadas por el CSMV, que son las que finalmente se introducen en la ficha técnica, prospecto y, en su caso, en el etiquetado):
El resto de modificaciones de la autorización de comercialización fueron tratadas en este Comité únicamente para información de sus miembros, puesto que se trataba de procedimientos europeos con un calendario más corto, no siendo posible discutir previamente estos procedimientos en este Comité.
| MEDICAMENTO | PROPUESTA DE MODIFICACIÓN DE LOS TEXTOS |
|---|---|
| ALFAXAN (1898 ESP) | Incluir como efectos adversos signos neurológicos, cardiorespiratorios y de comportamiento observados. |
| EFFITIX 402MG/3600MG SOLUCIÓN SPOT-ON PARA PERROS MUY GRANDES, EFFITIX 268MG/2400MG SOLUCIÓN SPOT-ON PARA PERROS GRANDES, EFFITIX 134MG/1200MG SOLUCIÓN SPOT-ON PARA PERROS MEDIANOS, EFFITIX 67MG/600MG SOLUCIÓN SPOT-ON PARA PERROS PEQUEÑOS, EFFITIX 26.8MG/240MG SOLUCIÓN SPOT-ON PARA PERROS MUY PEQUEÑOS (3098-3102 ESP) | Incluir alteraciones neurológicas (letargia, ataxia, temblor muscular y convulsiones), así como alopecia y eritema en el punto de aplicación. |
| PERFIKAN 402MG/3600MG SOLUCIÓN SPOT-ON PARA PERROS MUY GRANDES, PERFIKAN 268MG/2400MG SOLUCIÓN SPOT-ON PARA PERROS GRANDES, PERFIKAN 134MG/1200MG SOLUCIÓN SPOT-ON PARA PERROS MEDIANOS, PERFIKAN 67MG/600MG SOLUCIÓN SPOT-ON PARA PERROS PEQUEÑOS, PERFIKAN 26.8MG/240MG SOLUCIÓN SPOT-ON PARA PERROS MUY PEQUEÑOS (3072-3076 ESP) | Incluir alteraciones neurológicas (letargia, ataxia, temblor muscular y convulsiones), así como alopecia y eritema en el punto de aplicación. |
| NOBILIS IB 4-91 LIOFILIZADO PARA SUSPENSIÓN (EU/2/98/006/001) | Incluir en el apartado 4.5 Precauciones especiales de uso, una advertencia para los usuarios de la vacuna sugiriendo el empleo de equipos de protección individual: «En caso de administración por nebulización, usar un equipo de protección individual, consistente en una máscara con protección ocular, al manipular el medicamento veterinario». |
| VECTRA FELIS 423 MG/42,3 MG SOLUCION SPOT-ON PARA GATOS (EU/2/14/165/001-007) | Incluir alteraciones en el punto de aplicación tales como eritema, prurito, lesiones e inflamación, así como los signos hiperactividad, taquipnea y prurito. |
| NOBIVAC KC (1362 ESP) | Inclusión del siguiente texto en el apartado 4.6 de la ficha técnica: «En muy raras ocasiones, pueden aparecer reacciones de hipersensibilidad. Tales reacciones pueden evolucionar a una condición más severa (anafilaxia), que puede ser potencialmente mortal. Si se producen tales reacciones se recomienda un tratamiento adecuado.». |
| COVINAN 100 MG/ML SUSPENSIÓN INYECTABLE (2823 ESP) | Modificar los textos autorizados para indicar que hiperplasias mamarias pueden producirse también en perras tras la administración del producto. |
| DRAXXIN 25 MG/ML SOLUCIÓN INYECTABLE PARA GANADO PORCINO (EU/2/03/041/006) Y DRAXXIN 100 MG/ML SOLUCIÓN INYECTABLE PARA GANADO BOVINO, PORCINO Y OVINO (EU/2/03/041/001) | Incluir en el apartado 4.5 Precauciones especiales para su uso en animales la siguiente advertencia: «Si se produce una reacción de hipersensibilidad, administrar un tratamiento apropiado de inmediato.» |
| INFLACAM 5 MG/ML SOLUCION INYECTABLE PARA PERROS Y GATOS (EU/2/11/134/015), RHEUMOCAM 5 MG/ML SOLUCION INYECTABLE PARA PERROS Y GATOS (EU/2/07/078/015) | Modificar el apartado Reacciones adversas (frecuencia y gravedad) para hacer referencia a que las reacciones pueden producirse también en gatos. |
| SARNACURAN (2374 ESP) | Incluir como contraindicación su uso en pollos por haberse observado una toxicidad elevada. |
| RABISYVA VP-13 (3029 ESP) | Incluir en el apartado de reacciones adversas: «Se observaron reacciones de hipersensibilidad en muy raras ocasiones, en cuyo caso debe administrarse tratamiento sintomático apropiado.» |
| FRONTLINE TRI-ACT SOLUCIÓN SPOT-ON PARA PERROS (3089 ESP, 3090 ESP, 3091 ESP, 3092 ESP Y 3093 ESP) | Incluir en el apartado de reacciones adversas los signos «eritema», «anorexia» y «ataxia». Se hace una referencia cruzada en el apartado contraindicaciones al apartado precauciones especiales para su uso en animales por las reacciones potencialmente fatales en gatos, además de añadir un pictograma de contraindicación en gatos. |
| LEUCOFELIGEN FELV/RCP (EU/2/09/097/001) | Incluir en el apartado de reacciones adversas la posibilidad de producirse reacciones febriles del síndrome de cojera en gatitos. |
| ERYSENG (UE/2/14/166/001- 007), ERYSENG PARVO (UE/2/14/167/001-007) | Incluir en el apartado de reacciones adversas reacciones de tipo anafiláctico. |
| ZYCORTAL 25 MG/ML SUSPENSIÓN INYECTABLE DE LIBERACIÓN PROLONGADA PARA PERROS (EU/2/15/189/001) | Incluir en el apartado de reacciones adversas: «Los trastornos del páncreas se han reportado muy raramente después del uso de Zycortal. La administración simultánea de glucocorticoides puede contribuir a estos signos.» |
| FLORTEK 100 MG/ML SOLUCIÓN PARA ADMINISTRACIÓN EN AGUA DE BEBIDA PARA PORCINO (3054 ESP) | Incluir en el apartado Posología y vía de administración: «No usar este producto con agua clorada». |
| FLORFENICEN 200/20 MG/ ML (3410 & 3411 ESP) | Incluir en el apartado de reacciones adversas la siguiente frase «En raras ocasiones se pueden observar signos neurológicos y muerte en los animales tratados. En caso de observarse, debe retirarse la medicación inmediatamente y proporcionar agua sin medicar a los animales.» |
| ENGEMICINA 100 MG/ML (2665 ESP) | Se incluye en el apartado de posología y vías de administración la siguiente frase: «No administrar el régimen de dosis altas-acción prolongada a animales en lactación cuya leche se destine al consumo humano.» |
| APISTAN (2680 ESP) | Incluir en el apartado de advertencias especiales para cada especie de destino la siguiente frase: «El medicamento veterinario debe utilizarse como parte de un programa integrado de control de varroa. Como método eficaz para reducir el riesgo de selección de resistencias, al igual que con otros acaricidas, Apistan no debe utilizarse en años consecutivos. En su lugar, debe aplicarse rotación estricta con medicamentos veterinarios que contengan sustancias activas de diferentes clases químicas. Dependiendo del estado de resistencias de la región, podría ser necesario interrumpir el tratamiento durante más de un año. Un uso inadecuado del medicamento veterinario podría aumentar el riesgo de desarrollo de resistencias y finalmente resultar en una terapia ineficaz. En general se recomienda testar la sensibilidad a los acaricidas a nivel regional, p. ej. por bioanálisis o análisis molecular (PCR). Se debe controlar rutinariamente el nivel de infestación de ácaros (varroa) en las colmenas antes y después del tratamiento para determinar la efectividad del mismo. No utilizar el medicamento en colonias donde es conocida la resistencia de los ácaros a otros piretroides (por ejemplo, la flumetrina), ya que se produce resistencia cruzada.» |
| NOBIVAC PUPPY (3193 ESP), NOBIVAC PARVO-C (3195 ESP), NOBIVAC DHPPI (3194 ESP) Y NOBIVAC DHP (3192 ESP) | Modificar en el apartado de propiedades inmunológicas la frase relativa a la interferencia de la vacuna con los anticuerpos maternales para reforzar el seguimiento estricto del programa vacunal recomendado en la Ficha técnica. Se elimina también del apartado de reacciones adversas la siguiente frase «Este tipo de reacción es, en la mayoría de los casos, de carácter leve, transitorio y auto limitante» referente a las reacciones de hipersensibilidad. |
Comité técnico del sistema español de farmacovigilancia de medicamentos veterinarios (CTSEF-VET)
El CTSEF-VET es el órgano colegiado de la AEMPS que tiene por objeto unificar los criterios de funcionamiento y evaluar las Señales a MV detectadas por el Sistema Español de Farmacovigilancia de Medicamentos Veterinarios.
Es importante destacar que cuenta con la participación de todas las comunidades autónomas y de las ciudades autónomas de Ceuta y Melilla.
Se celebró una reunión en 2019, siendo lo fundamental a destacar: la revisión de las actividades de los distintos agentes en base a las obligaciones recogidas en el documento de Buenas Prácticas de Farmacovigilancia Veterinaria del Sistema Español de Farmacovigilancia Veterinaria, y se discutieron los informes preparados por el DMV relativos a los procedimientos de Detección de Señales realizados a nivel europeo y nacional.
Alertas e informaciones de seguridad no urgente (NUIS) por razones de farmacovigilancia
En el 2019 no se decretó ninguna alerta.
En el 2019 se envió desde España una solicitud de información de seguridad no urgente (problemas neurológicos y muerte en cerdos tras administración en agua de bebida de medicamentos que contienen florfenicol) y se recibieron y gestionaron, por afectar a MV registrados en España, 9 NUIS.
Alertas por defectos de calidad
En el 2019 se decretaron seis alertas por defectos de calidad:
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ1/2019: Meloxidolor 5 mg/ml solución inyectable para perros, gatos, bovino y cerdos.
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ2/2019: Anaestamine 100 mg/ml solución inyectable.
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ3/2019: Norocarp 50 mg/ml (2053 ESP), Enrotril 100 mg/ ml (2231 ESP), Noromectin 10 mg/ml (1352 ESP), Noromectin 10 mg/ml (1659 ESP), Alamycin LA 300 (1319 ESP), Norocarp 50 mg/ml (2001 ESP) y Paramectin inyectable (1442 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ4/2019: Carprosan 50 mg/ml solución inyectable para bovino (2767 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ5/2019: Suictine, con número de registro 1638 ESP, y Promectine con número de registro 1475 ESP
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ6/2019: Ivertin 10 mg/ml solución inyectable para bovino, ovino y porcino (3381 ESP)
Promoción de la farmacovigilancia veterinaria
La promoción de la FVV sigue siendo un punto estratégico para la AEMPS además de una obligación legal contemplada en las directivas europeas y en el Real Decreto 1246/2008. Esta prioridad se fundamenta en que la UE considera prioritario incrementar los niveles de notificación, por lo que se ha incluido este objetivo en la planificación estratégica del Grupo de Jefes de Agencias de la UE (HMA) y en su Subgrupo de Estrategias de Farmacovigilancia (ESS).
En 2019 se impartieron charlas técnicas destinadas a la formación de futuros veterinarios en las Facultades de Veterinaria de: Barcelona, Valencia (tanto en el CEU Cardenal Herrera como en la Universidad Católica de Valencia), León, Madrid, Murcia, Córdoba, Zaragoza y Las Palmas.
Se participó igualmente en una Jornada sobre Toxicología Veterinaria organizada por la Facultad de Veterinaria de Cáceres, con el fin de actualizar la formación continua de veterinarios en este aspecto.
Del mismo modo se participó en el máster de Farmacoepidemiología y Farmacovigilancia organizado por la Universidad de Alcalá de Henares.
Participación en reuniones internacionales
En relación con las actividades de FVV a nivel europeo en 2019, cabe destacar la participación en los siguientes Grupos y Comités: Grupo de Farmacovigilancia Veterinaria del CVMP, Subgrupo de Terminología VEDDRA, Grupo Regulators sobre el programa de Worksharing de IPS y Subgrupo ESS de HMA.
Así como la participación de dos expertos seleccionados activamente en el desarrollo de los actos de desarrollo del Reglamento (UE) 2019/6 del Parlamento Europeo y del Consejo, de 11 de diciembre de 2018, sobre medicamentos veterinarios y por el que se deroga la Directiva 2001/82/CE.
Otras actividades
Se participó como ponente en los Cursos del Plan de Formación Interna de la AEMPS en las áreas siguientes:
- Reglamento (UE) 2019/6: Implicaciones en Farmacovigilancia, Defectos de Calidad y Comercio Exterior.
- Efectos adversos y sistemas de notificación.
- EudraVigilanceVet (EVVet) y VigiaVet.
- Detección de señales. Metodología para la detección de señales de medicamentos centralizados en Datawarehouse (DWH) – EVVet. Herramientas estadísticas.
- Reglamento (UE) 2019/6: Implicaciones en Farmacovigilancia, Defectos de Calidad y Comercio Exterior
- Datawarehouse (DWH) y búsquedas más utilizadas para realizar detección de señales.
- Sistema de Gestión de Calidad del DMV de la AEMPS.

