Última actualización: 08/03/2016
Puede consultar esta nota en formato pdf
Consulte también al final de esta nota informativa la actualización de 8 de marzo de 2016 concerniente a: pacientes de alto riesgo de desarrollar LMP asociada al tratamiento con natalizumab, estimadores de riesgo de LMP en pacientes tratados con natalizumab y disponibilidad de las pruebas de anticuerpos anti-virus JC.
NATALIZUMAB (▼TYSABRI): NUEVAS RECOMENDACIONES PARA MINIMIZAR EL RIESGO DE LEUCOENCEFALOPATÍA MULTIFOCAL PROGRESIVA
(Recomendaciones del Comité para la Evaluación de Riesgos en Farmacovigilancia europeo-PRAC)
Modificación de 16 de febrero de 2016 (ver nota al final)*
Fecha de publicación: 12 de febrero de 2016
Categoría: MEDICAMENTOS DE USO HUMANO, SEGURIDAD.
Referencia: MUH (FV), 1/2016
Tras la evaluación de los datos disponibles sobre el riesgo de leucoencefalopatía multifocal progresiva (LMP), asociado al tratamiento con natalizumab (Tysabri®), el Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) ha recomendado nuevas medidas orientadas a la detección precoz de LMP con el objetivo de mejorar su pronóstico.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) informa acerca de los resultados de la reciente revisión europea en relación con el riesgo de Leucoencefalopatía Multifocal Progresiva (LMP) asociado al tratamiento con natalizumab (Tysabri®).
Tysabri® es un medicamento que contiene natalizumab, un anticuerpo humanizado recombinante anti-α4-integrina indicado, como tratamiento modificador de la enfermedad en monoterapia, en la esclerosis múltiple remitente recidivante (EMRR) muy activa en grupos seleccionados de pacientes (consultar la ficha técnica de Tysabri® para una información detallada).
La LMP es una enfermedad desmielinizante de curso subagudo o crónico que afecta a la sustancia blanca subcortical del sistema nervioso central y que está causada por un papovavirus oportunista, el virus John Cunningham (virus JC), que suele estar presente en la población general, pero que sólo origina LMP si el sistema inmunitario se encuentra debilitado. Se trata de una enfermedad rara pero grave, que puede llegar a provocar la muerte o la severa discapacidad del paciente.
Es un hecho conocido que el uso de natalizumab se encuentra asociado a un incremento del riesgo de desarrollar LMP, siendo factores de riesgo la presencia de anticuerpos frente al virus JC, una duración de tratamiento superior a dos años y el uso previo de inmunosupresores.
El análisis de datos recientes de estudios clínicos indica además lo siguiente:
- Resulta determinante poder diagnosticar la LMP en fase asintomática. Su diagnóstico precoz y tratamiento temprano limitan el grado de daño cerebral y mejoran la tasa de supervivencia.
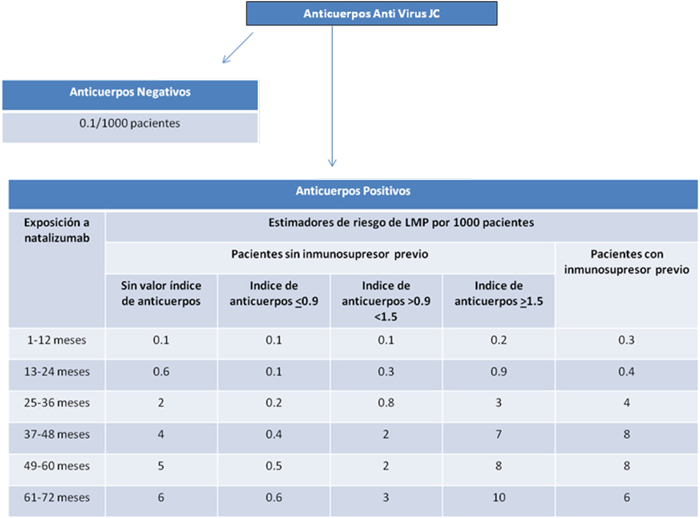
- En aquellos pacientes con anticuerpos anti virus JC positivos a los que antes de recibir natalizumab no se les haya administrado ningún tipo de tratamiento inmunosupresor, el índice de anticuerpos y la duración del tratamiento determinan el nivel de riesgo de desarrollo de LMP. Se considera que el riesgo de LMP es bajo si el índice de anticuerpos anti virus JC es menor o igual a 0.9 y aumenta progresivamente, estando sustancialmente elevado cuando dicho índice alcanza valores superiores a 1.5 en pacientes que han estado en tratamiento con natalizumab durante más de dos años.
En base a la evaluación realizada por el PRAC y con el objeto de intentar diagnosticar precozmente la LMP en pacientes que reciben natalizumab, mejorando así su pronóstico, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) recomienda a los profesionales sanitarios:
- En los pacientes con alto riesgo de desarrollar LMP, realizar una evaluación pormenorizada caso por caso, y sólo instaurar natalizumab si se considera que el beneficio esperado supera los riesgos potenciales.
-
En cualquier caso, se recomienda:
-
Antes de iniciar el tratamiento con natalizumab:
- Informar a los pacientes y/o sus cuidadores sobre el riesgo de LMP y sobre los síntomas sugestivos de la enfermedad, indicándoles que consulten inmediatamente con un médico en caso de que estos aparezcan.
- Realizar una determinación del título de anticuerpos anti virus JC y disponer de una resonancia magnética (RNM) cerebral (realizada en los tres últimos meses) con el objeto de utilizar ambas pruebas como referencia.
-
Una vez iniciado el tratamiento con natalizumab:
- Vigilar la aparición de signos y síntomas de disfunción neurológica, realizando RNM al menos anualmente. En pacientes con riesgo mayor de LMP se recomienda realizar resonancias magnéticas abreviadas (p. ej. FLAIR) cada 3-6 meses.
- Realizar determinaciones de anticuerpos cada 6 meses a los pacientes con anticuerpos anti virus JC negativos y a aquellos con un índice bajo de anticuerpos y sin tratamiento inmunosupresor previo, una vez hayan alcanzado los dos años de tratamiento.
- Se considerará la LMP en el diagnóstico diferencial de cualquier paciente que reciba natalizumab y presente síntomas neurológicos y / o aparición de nuevas lesiones cerebrales en la resonancia magnética.
- Siempre que se sospeche LMP, deberá suspenderse inmediatamente el tratamiento y no iniciarse de nuevo hasta que no se haya excluido este diagnóstico.
- Después de 2 años de tratamiento se informará de nuevo al paciente sobre el riesgo de LMP.
-
Una vez finalizado el tratamiento con natalizumab:
- Deberá mantenerse el protocolo de monitorización durante 6 meses, ya que han sido notificados casos de LMP durante ese periodo de tiempo, informando a los pacientes de que deberán mantener una actitud vigilante durante este periodo.
-
Antes de iniciar el tratamiento con natalizumab:
Estas recomendaciones, deberán ser valoradas por el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) y posteriormente hacerse efectivas mediante la correspondiente Decisión de la Comisión Europea. La AEMPS emitirá una nueva nota informativa, en caso de que dicha Decisión difiera sustancialmente de las recomendaciones que acaban de exponerse.
Asimismo, se comunica que las recomendaciones serán incorporadas a la Ficha Técnica y Prospecto de Tysabri® y que se actualizarán los materiales informativos sobre seguridad, en los que se encontrará información detallada sobre el riesgo de LMP y los datos que sustentan las recomendaciones realizadas. Los materiales informativos estarán disponibles en la sección CIMA de la web de la AEMPS, junto con la información del producto, y en la sección correspondiente de esta web para materiales sobre seguridad de medicamentos.
Finalmente se recuerda la importancia de notificar todas las sospechas de reacciones adversas al Centro Autonómico de Farmacovigilancia correspondiente del Sistema Español de Farmacovigilancia, pudiéndose notificar también a través del formulario electrónico disponible en la web https://www.notificaram.es/.
*Modificación de 16 de febrero de 2016: se ha modificado lo siguiente:
En el apartado del análisis de los datos de los estudios clínicos, se ha suprimido la información relativa a la consideración de pacientes de alto riesgo (página 2 del documento en pdf).
Al final de las recomendaciones de la página 3 del pdf, se ha añadido el siguiente párrafo:
“Estas recomendaciones, deberán ser valoradas por el Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) y posteriormente hacerse efectivas mediante la correspondiente Decisión de la Comisión Europea. La AEMPS emitirá una nueva nota informativa, en caso de que dicha Decisión difiera sustancialmente de las recomendaciones que acaban de exponerse.”
Se ha eliminado el Anexo del final de la nota: “Estimadores de riesgo actualizados para el desarrollo de LMP en pacientes tratados con natalizumab”.
El pasado 26 de febrero finalizó la revisión europea sobre la actualización de las recomendaciones para minimizar el riesgo de LMP asociado al uso de natalizumab (Tysabri®)1. Las recomendaciones finalmente adoptadas coinciden con las realizadas por la AEMPS el pasado 16 de febrero.
Adicionalmente, la AEMPS desea ampliar la información respecto al nivel de riesgo de LMP en pacientes tratados con natalizumab y sobre la disponibilidad de las pruebas de titulación de anticuerpos frente al virus JC:
- En base a los nuevos datos disponibles se consideran pacientes de alto riesgo de desarrollar LMP asociada al tratamiento con natalizumab aquellos que:
- Hayan recibido tratamiento inmunosupresor anteriormente a natalizumab y además tengan anticuerpos anti virus JC positivos y además hayan sido tratados con natalizumab durante más de dos años.
- No hayan recibido tratamiento inmunosupresor anteriormente a natalizumab pero tengan un alto índice de anticuerpos anti virus JC y hayan recibido tratamiento con natalizumab durante más de dos años.
- Los estimadores actuales de riesgo anual global de LMP basados en estudios clínicos atendiendo a la exposición previa de inmunosupresor, duración del tratamiento e índice de anticuerpos se indican en la figura 1.
- Disponibilidad de las pruebas de anticuerpos anti virus JC:
- El laboratorio Titular de la Autorización de comercialización de Tysabri® (Biogen), pone a disposición de los facultativos la prueba de determinación de anticuerpos en suero mediante el análisis validado STRATIFY JCV.
- Para ello, se puede visitar la página web www.stratifyjcv.com (es necesario registrarse) y solicitar materiales para la toma de muestras (seleccionando “pedidos” en dicha web). Con ello, se recibirá un set de recogida de muestra completo (contiene el material e información necesarios para la obtención de la muestra y su transporte). El transporte se puede programar a través de la propia web o telefónicamente.
- Se podrá obtener información más detallada en el material de información sobre seguridad que próximamente estará disponible.
Figura 1: Estimadores de riesgo de LMP en pacientes tratados con natalizumab
1.EMA confirms recommendations to minimise risk of brain infection PML with Tysabri: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2016/02/news_detail_002476.jsp&mid=WC0b01ac058004d5c1

