NIPO: 134-24-006-3
Información dirigida a profesionales sanitarios
- Notificaciones individuales de sospechas de acontecimientos adversos
- Modificaciones de ficha técnica y estudios posteriores a la autorización
- Procedimientos centralizados, descentralizados y de reconocimiento mutuo
- Comité de Seguridad de Medicamentos Veterinarios
- Comité Técnico del Sistema Español de Farmacovigilancia de Medicamentos Veterinarios
- Alertas e informaciones de seguridad no urgente por razones de farmacovigilancia
- Alertas por defectos de calidad
- Promoción de la farmacovigilancia veterinaria
- Participación en reuniones internacionales
Pese a la extensa información aportada para garantizar la calidad, seguridad y eficacia durante la solicitud de autorización de comercialización, solo es posible contar con un conocimiento completo del comportamiento de los medicamentos veterinarios una vez que se han registrado. Es en estas condiciones reales de uso de los medicamentos veterinarios cuando pueden aparecer problemas de eficacia o de seguridad novedosos que pueden ser relevantes: por ejemplo, al administrarlo a especies animales no autorizadas (en base a los preceptos legales de prescripción excepcional); cuando se utiliza en las diferentes razas de cada especie, en diversas condiciones de manejo, o cuando se administra a animales con patologías concomitantes o que reciben tratamientos con más de un medicamento (circunstancia bastante común en el ámbito veterinario). Por otra parte, una vez registrado el medicamento veterinario, su uso alcanza a miles de animales y solo entonces pueden dar la cara acontecimientos adversos (AA) que tengan una incidencia muy baja y que no se han observado en los estudios preclínicos y clínicos.
Es aquí donde cobra importancia la actividad de Salud Pública que tiene por objeto la identificación, cuantificación, evaluación y prevención de los riesgos del uso de los medicamentos veterinarios una vez comercializados, permitiendo así el seguimiento de los posibles acontecimientos adversos, o lo que es lo mismo, farmacovigilancia. Es por ello que se creó el Sistema Español de Farmacovigilancia de Medicamentos Veterinarios (mediante el Real Decreto 1246/2008) buscando confirmar si el balance beneficio/riesgo del uso de los medicamentos veterinarios se mantiene dentro de los márgenes conocidos desde su autorización, identificando si hay nuevos riesgos o si la gravedad y/o frecuencia de los riesgos ya conocidos ha variado significativamente. En base a ello, instaurar medidas para evitar o minimizar sus consecuencias y poder así gestionar adecuadamente los riesgos para la salud pública, la sanidad animal y el medio ambiente.
Para el funcionamiento de este sistema es imprescindible la participación activa de los profesionales sanitarios, muy especialmente de los veterinarios, dado que se nutre de las notificaciones de sospechas de acontecimientos adversos realizadas por los mismos.
Es importante recordar que el hecho de que se observen AA a un medicamento veterinario no debe ser considerado como algo extraordinario, ya que no hay ningún medicamento veterinario que sea totalmente inocuo o esté exento de poder causar reacciones, ni ningún medicamento veterinario que sea 100% eficaz. De ahí la necesidad de implementar un sistema de farmacovigilancia y una evaluación técnica del balance beneficio/riesgo, para aportar a todos los interesados (profesionales sanitarios, ganaderos, propietarios de los animales y usuarios en general) la mejor información que ayude a tomar las mejores decisiones de tratamiento en cada momento.
Conforme establece la legislación europea (Reglamento (UE) 2019/6), la farmacovigilancia cubre toda una serie de situaciones (más amplias que las que se contemplan en la farmacovigilancia de medicamentos de uso humano), incluyendo aspectos de seguridad y eficacia en los animales de destino, de seguridad en las personas que manipulan los medicamentos veterinarios o que entran en contacto con los animales a los que se les ha administrado el medicamento veterinario, en los consumidores de alimentos de origen animal (los problemas derivados de unos residuos mayores que los Límites Máximos de Residuos –LMR– aprobados en la UE) con las consiguientes repercusiones en la salud pública, así como problemas medioambientales. De forma global, pueden considerarse como sospechas de AA los siguientes casos:
- Sospechas de reacciones adversas (RA) en animales en condiciones normales de empleo del medicamento veterinario, es decir, cuando su empleo es conforme con su autorización de comercialización y, por tanto, en línea con lo establecido en la ficha técnica o resumen de características del medicamento.
- Sospechas de RA tras el “uso no contemplado”, siendo éste el que corresponde a cualquier variación respecto a lo establecido en la autorización del medicamento veterinario.
- Sospechas de falta de la eficacia esperada.
- Sospechas de insuficiencia de los tiempos de espera. La responsabilidad de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) es garantizar que si se respeta el tiempo de espera fijado en la autorización no aparecerán residuos por encima de los LMR en los alimentos de origen animal obtenidos de los animales tratados. De no ser así, se podría solicitar al titular la correspondiente variación para aumentar el tiempo de espera.
- Sospechas de reacciones en personas, que se pueden producir durante la administración del producto a los animales, contacto con el mismo, inyecciones accidentales, etc.
- Sospechas de problemas medioambientales, como consecuencia de los tratamientos administrados a los animales.
- Sospechas de transmisión de agentes infecciosos como consecuencia de tratamientos con medicamentos veterinarios.
- Sospechas de reacciones adversas en animales a medicamentos de uso humano.
Las principales actividades que desarrolla la AEMPS en competencia veterinaria son la gestión y evaluación de las notificaciones individuales de AA, ya sean comunicadas por profesionales sanitarios, propietarios de animales o ganaderos (bien directamente a través de la Tarjeta Verde o bien a través de la aplicación NotificaVET), o comunicadas por los titulares directamente a la base de datos europea EudraVigilance Veterinary (EVVET/UPhD). Desde la AEMPS se realiza asimismo, un seguimiento continuado de la calidad de los datos en EVVET/UPhD de los casos reportados en nuestro país, lo cual influye muy directamente en la ejecución de una detección de señales de calidad.
Además, se chequea un tipo de información que los titulares aportan dentro de cada procedimiento de registro, que son los resúmenes de los archivos maestros de los sistemas de farmacovigilancia (PSMF/AMSF), en los que describen cómo llevan a cabo las tareas principales de farmacovigilancia. Como consecuencia de toda esta labor, la AEMPS es responsable de proponer la instauración de medidas reguladoras como son: obligar a los titulares a presentar variaciones de seguridad, la solicitud de estudios post-autorización o, incluso, si el desequilibrio en el balance beneficio/riesgo no se pudiera corregir de manera efectiva, proponer la suspensión o la revocación definitiva de la autorización, decretando en estos supuestos una alerta.
Asimismo, la AEMPS evalúa y gestiona las alertas de farmacovigilancia y las notificaciones europeas de seguridad no urgentes (NUIS) a nivel nacional e internacional, que son publicadas posteriormente en la web de la AEMPS, y el seguimiento y control de las medidas reguladores instauradas sobre las autorizaciones de los medicamentos veterinarios afectados en las alertas.
Por último, también se llevan a cabo de forma periódica los análisis de detección de señales de los medicamentos veterinarios autorizados por procedimiento centralizado de los que somos ponentes, así como de los medicamentos veterinarios autorizados por procedimiento de reconocimiento mutuo o descentralizado y nacional, siempre que sea necesario. Este trabajo está coordinado a nivel europeo por el P-SMEG (Pilot Signal Management Expert Group), del que forma parte la AEMPS. Para ello, se utiliza el repositorio unificado (Data Warehouse) que permite realizar búsquedas en EVVET/UPhD, donde se accede a todos los AA que se hayan notificado, ocurridas tanto en la UE como en países terceros. De esta forma, a pesar de que, de acuerdo a la nueva legislación, los titulares tienen la responsabilidad de supervisar la farmacovigilancia de sus medicamentos veterinarios, desde la AEMPS, se realiza un seguimiento continuado de la misma, con el fin de detectar y/o complementar los datos que pudieran revelar un cambio en el beneficio/riesgo.
El presente boletín recoge las actividades de farmacovigilancia llevadas a cabo por la AEMPS a través del Departamento de Medicamentos Veterinarios, siendo una herramienta básica de comunicación entre todos los implicados en general y, especialmente para los veterinarios, sobre la vigilancia continua de la eficacia y seguridad de los medicamentos veterinarios.
Notificaciones individuales de sospechas de acontecimientos adversos
La notificación o comunicación de un acontecimiento adverso (AA) a un medicamento veterinario es obligatoria conforme la legislación nacional, tanto para los profesionales sanitarios como para los titulares. Para armonizar y simplificar estas notificaciones en la UE, la red de agencias europeas de medicamentos veterinarios elaboró un formulario para uso exclusivo de profesionales sanitarios, que en España se ha editado en formato papel conocido como Tarjeta Verde. Actualmente, la AEMPS también posee un sistema de notificación electrónica: NotificaVET, de reciente creación, dirigido a profesionales sanitarios y al público en general.
NotificaVET tiene también la opción para que el público en general notifique sospechas de AA con otro formulario más adaptado. Independientemente de la vía de notificación (Tarjeta Verde, NotificaVET, etc.) toda esta información se incorpora a la base de datos nacional de farmacovigilancia (VIGÍA-VET-2), y una vez validada dicha información, se registra en la base de datos europea EVVET/UPhD.
Además, la aplicación de prescripción veterinaria del Consejo General de Colegios Veterinarios (PRESCRIVET) así como la del Consejo General de Colegios de Veterinarios de Andalucía (RECEVET), cuentan con un espacio de notificación de sospechas de acontecimientos adversos.
El número de notificaciones de AA en España en 2023 alcanzó las 4.393.
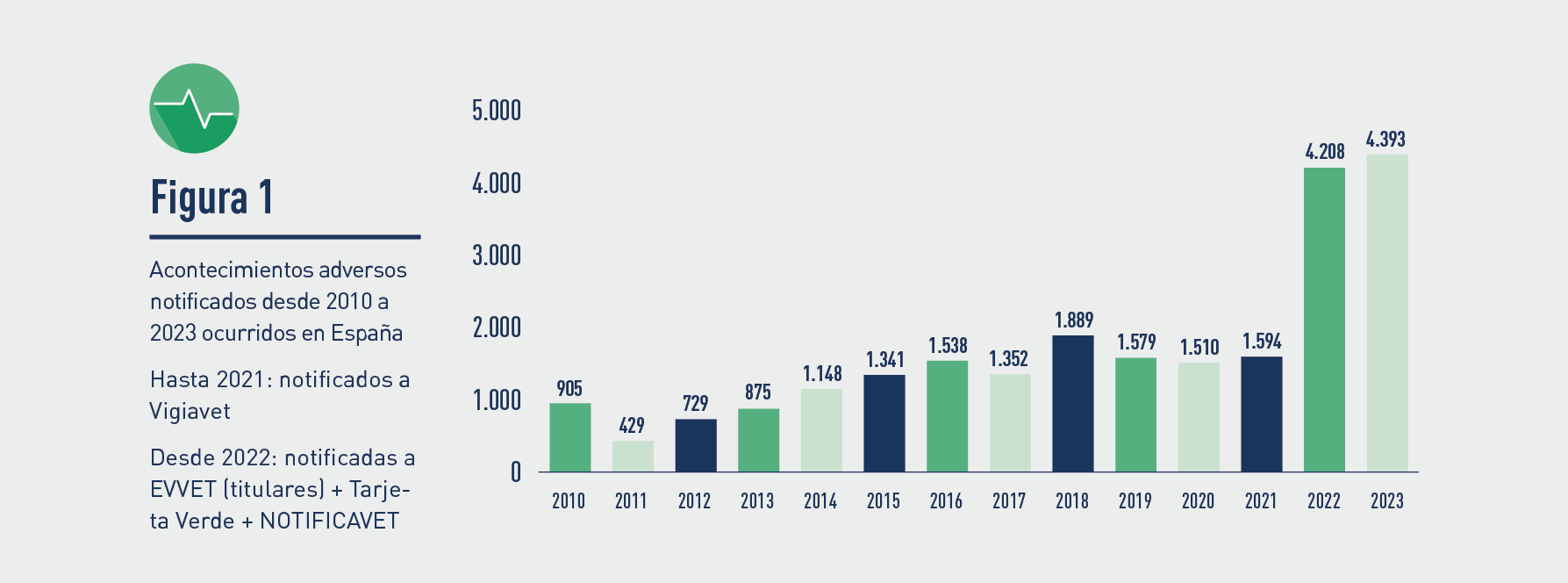
La diferencia de casos entre 2021 y 2022 se debe al cambio de legislación, tras el cual los titulares tienen que notificar individualmente a EVVET todos los casos -graves y no graves-. Antes del 28 de enero de 2022 solo tenían obligación de notificar aquellas sospechas de acontecimientos adversos clasificadas en la anterior legislación como “expeditivas”, permitiéndose que las “no expeditivas” se acumulasen en los line listing de los Informes Periódicos de Seguridad, donde no se podían realizar consultas y conocer exactamente los casos ocurridos en cada Estado. La base legal vigente con respecto a la obligatoriedad de comunicación y registro de las sospechas recibidas por los titulares, se refleja en el artículo 76 del Reglamento 2019/6.
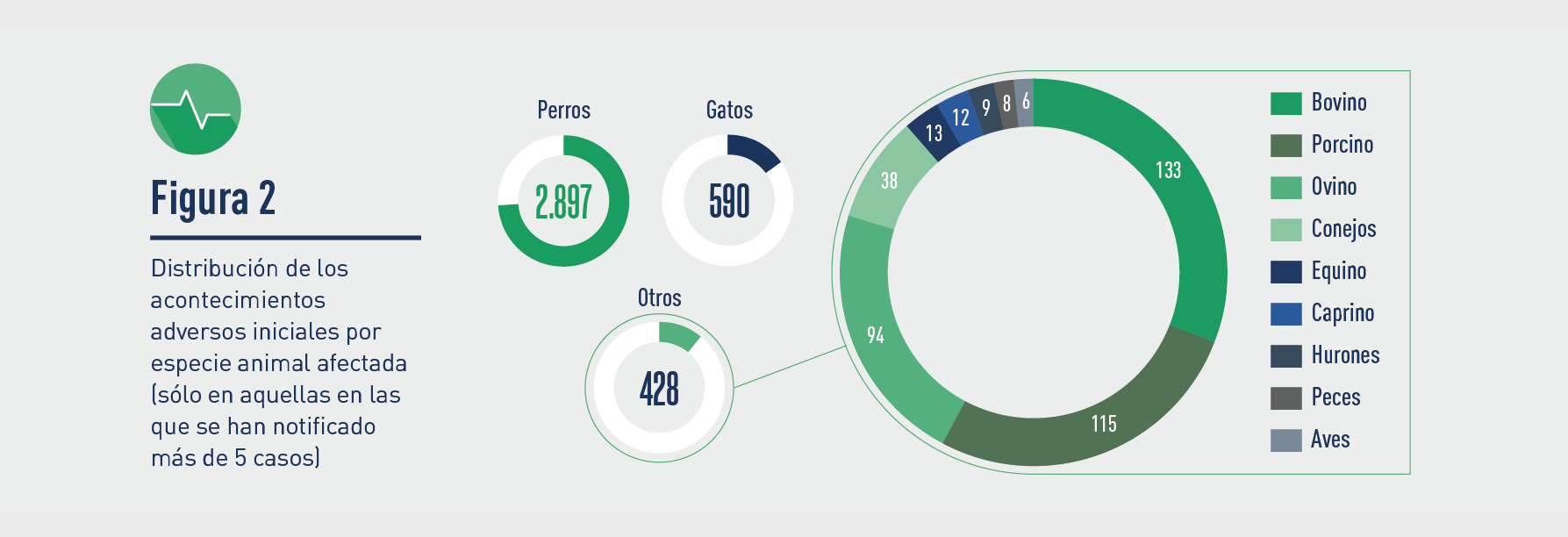
En cuanto a la estratificación de estos AA en 2023, las especies de destino en las que se presentaron fueron las siguientes: perro, gato, bovino, cerdo, ovino, conejo, caballo, caprino, hurones, peces y aves de corral.
Menos de 5 casos ocurrieron en las siguientes especies: otras aves (gorrión, flamenco, quebrantahuesos), ratón (1), lobo (1), oso (1), abejas (1).
Además, 43 casos afectaron a personas.
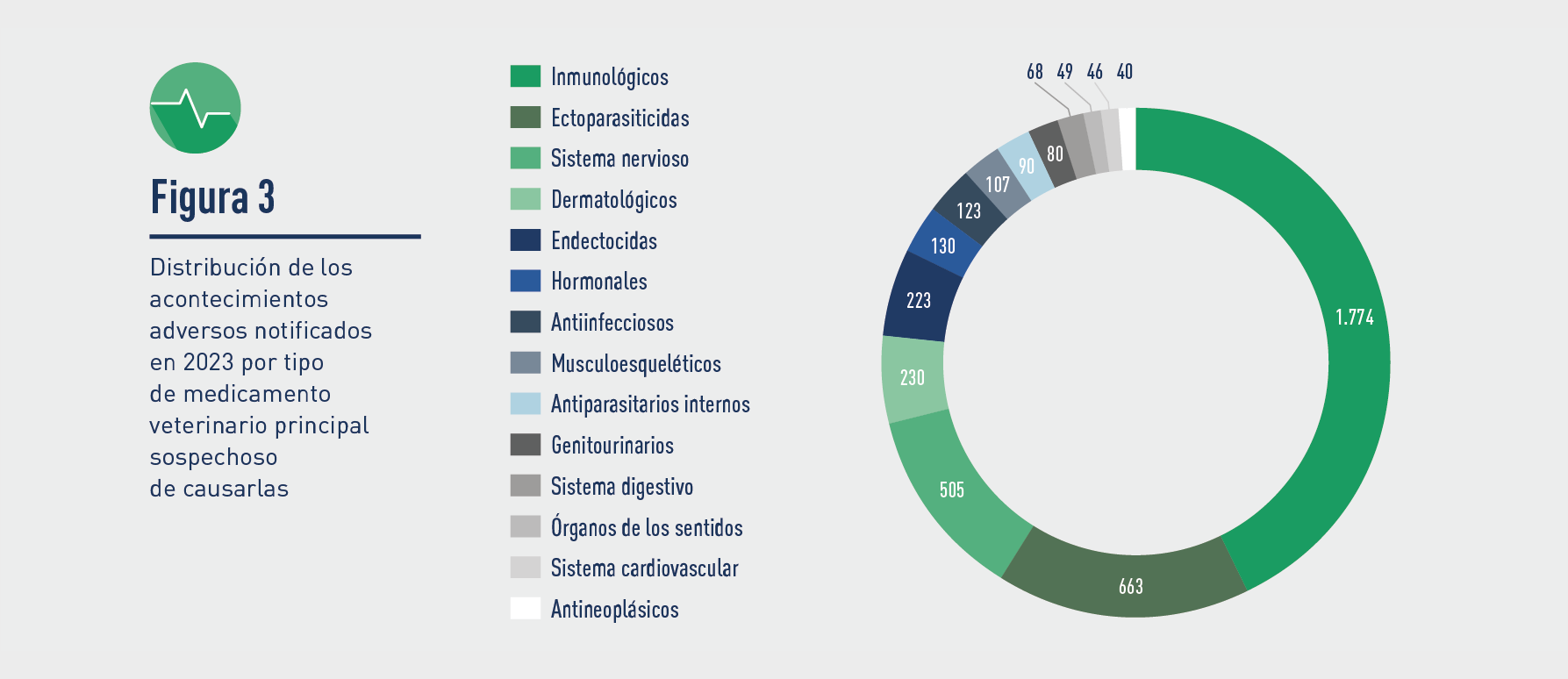
Con respecto a los medicamentos veterinarios implicados, los grupos en los que más frecuentemente se ha notificado corresponden a vacunas, ectoparasiticidas, medicamentos para el sistema nervioso, dermatológicos, endectocidas, hormonales y antimicrobianos.
Tras ellos, se encuentra medicamentos del sistema musculoesquéletico, antiparasitarios internos, sistema genitourinario, sistema digestivo, órganos sensoriales (ojo, oído), sistema cardiovascular y antineoplásicos.
Otros con menos de 35 casos: sistema respiratorio (9) y sangre (4).
Respecto del origen de las notificaciones iniciales de casos ocurridos en España, en 2023 de nuevo fue mayoritaria la realizada por los titulares (4.120 AA, un 93,7 %) frente al resto de posibles orígenes (profesionales sanitarios, ganaderos, propietarios de animales, otros usuarios, etc.), que notificaron (273 AA) el 6,21 %. Entre los otros posibles orígenes (referido a las recibidas directamente en la AEMPS), la gran mayoría fueron notificadas por veterinarios (81,61%), y en segundo lugar, por el Instituto Nacional de Toxicología.
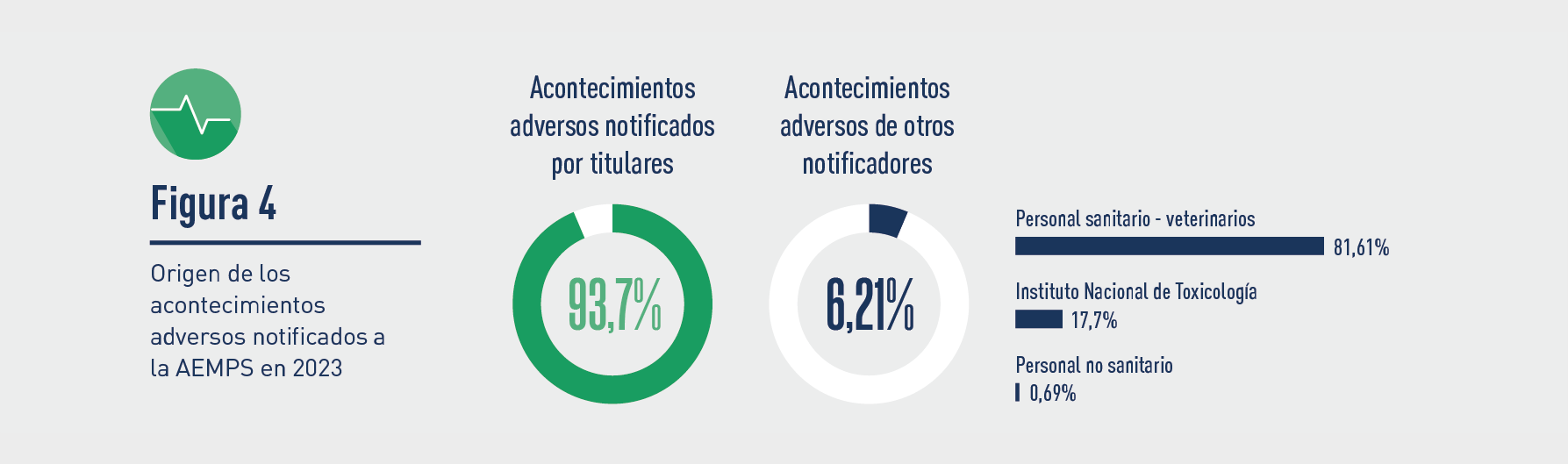
Conforme se establece en la normativa europea, la AEMPS ha enviado todas las AA notificadas en España a EVVET en un plazo máximo de 30 días.
Modificaciones de ficha técnica y estudios posteriores a la autorización
La legislación europea establece una serie de obligaciones en materia de farmacovigilancia para los titulares y entre ellas cabe destacar la de la realización de una detección de señales para cada uno de sus medicamentos veterinarios al menos una vez al año. Tras ello, si se observara un cambio en la relación beneficio/riesgo en alguno de sus medicamentos, la legislación establece la remisión por parte de los titulares de una variación para modificar las condiciones de autorización del medicamento. En el año 2023, se recibieron 419 variaciones, bien para adaptación de los textos a la nueva legislación (384 medicamentos) o cambios en los mismos por motivos de seguridad (36 medicamentos).
Tras su evaluación y, en su caso, previo dictamen del Comité de Seguridad de Medicamentos Veterinarios (CSMV), en todos los medicamentos se concluyó que era necesario proceder a la modificación de los Resúmenes de Características.
Por otro lado, con respecto a los Estudios Posteriores a la Autorización (EPA), se recibieron 2 notificaciones para este tipo de procedimientos, todos relacionados con problemas de farmacovigilancia y con el objeto de aclarar la causa de los mismos.
Procedimientos centralizados, descentralizados y de reconocimiento mutuo
En relación con el procedimiento de vigilancia y detección de señales de medicamentos veterinarios centralizados en EVVET /UPhD, en el año 2023 se realizaron 93 análisis, correspondientes a las revisiones para la detección de señales de los medicamentos veterinarios de los que España es ponente y/o responsable en el marco del P-SMEG (Pilot Signal Management Expert Group, grupo de trabajo de farmacovigilancia de la EMA).
Además de ello, se han realizado por este procedimiento un total de 144 Signal Detection ad hoc en diferentes grupos de medicamentos, y se continuó con un Targeted Signal Management iniciado el año anterior, sobre un grupo de medicamentos, cuyo estudio lidera España como responsable.
Comité de Seguridad de Medicamentos Veterinarios
El Comité de Seguridad de Medicamentos Veterinarios (CSMV) es el órgano colegiado de la AEMPS creado para el asesoramiento técnico y científico en todo lo relativo a farmacovigilancia de los medicamentos veterinarios.
En 2023 se celebró 1 reunión, en la que se trató la modificación de la autorización de comercialización de un total de 36 medicamentos veterinarios. Esta reunión se realizó conjuntamente con el Comité Técnico del Sistema Español de Farmacovigilancia Veterinaria (SEF-VET).
Los dictámenes del CSMV y los cambios acordados en procedimientos de reconocimiento mutuo, descentralizado y de renovaciones de autorizaciones de comercialización que fueron sometidos a evaluación o información del CSMV, junto a los que se presentaron para información, fueron los siguientes:
| MEDICAMENTO | PROPUESTA DE MODIFICACIÓN DE LOS TEXTOS |
|---|---|
| Vetemex 10 mg/ml solución inyectable para perros y gatos (3733 ESP) | En el apartado 3.6 de ficha técnica y 7, del prospecto, se añaden signos neurológicos y letargia. |
| Florflu 300-16.5 solución inyectable para bovino (3962 ESP) | En el apartado 3.5 de la ficha técnica y 6 del prospecto, se añade la frase relativa al riesgo para aves necrófagas y fauna salvaje. En el apartado 4.3 de la ficha técnica y 17 del prospecto, se añade la misma frase indicada. Sobre aves necrófagas. |
| Meganyl 50 mg/ml solución inyectable para bovino porcino y caballos (1763 ESP) | En el apartado 3.5 de la ficha técnica y 6 del prospecto, se añade la frase relativa al riesgo para aves necrófagas y fauna salvaje. En el apartado 4.3 de la ficha técnica y 17 del prospecto, se añade la misma frase indicada. Sobre aves necrófagas. |
| Nobivac respira bb solución inyectable en jeringa precargada para perros (3923 ESP) y Nobivac respira bb suspensión inyectable para perros (3924 ESP) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto , se añade el signo de reacciones de hipersensibilidad. |
| Spizobactin 750.000 ui / 125 mg comprimidos masticables para perros (3581 ESP), Spizobactin 1.500.000 ui / 250 mg comprimidos masticables para perros (3582 ESP) y Spizobactin 3.000.000 ui / 500 mg comprimidos masticables para perros (3583 ESP) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se añade la frase relativa a hematuria como posible efecto adverso en muy raras ocasiones. |
| Anesketin 100 mg/ml solución inyectable para perros gatos y caballos (2834 ESP) | En el apartado 3.6 de la ficha técnica y en ell 7 del prospecto se añade “edema pulmonar” ccmo efecto adverso. En el apartado 3.5 de la ficha técnica y 6 del prospecto, se añade información relativa a la administración en animales epilépticos. |
| Draxxin Plus 100 mg/ml + 120 mg/ml solución inyectable para bovino (3904 ESP) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se añaden las reacciones de hipersensibilidad. |
| Sensiblex 40 mg/ml solución inyectable para bovino (3566 ESP) | En el apartado 4.4 de la ficha técnica y 12 del prospecto, se añade la necesidad de medidas de soporte adicionales en casos de sospecha de parto deficiente. En el apartado 4.6 de la ficha técnica y el 6 del prospecto r se añade la necesidad de un diagnóstico de las reacciones adversas. |
| Megluvet (1863 ESP) | En el apartado 3.5 de la ficha técnica y 6 del prospecto, se añade la frase relativa al riesgo para aves necrófagas y fauna salvaje. En el apartado 4.3 de la ficha técnica y 17 del prospecto, se añade la misma frase indicada. Sobre aves necrófagas. |
| Nasym (EU/2/19/241/001) | En el apartado 4.6 de la ficha técnica y en el 6 del prospecto relativo a las reacciones adversas, se añaden reacciones de anafilaxia. |
| Bravecto 112,5 mg solución para unción dorsal puntual para perros muy pequeños, Bravecto 250 mg solución para unción dorsal puntual para perros pequeños, Bravecto 250 mg solución para unción dorsal puntual para perros pequeños, Bravecto 1000 mg solución para unción dorsal puntual para perros grandes, Bravecto 1400 mg solución para unción dorsal puntual para perros muy grandes (EU/2/13/158/016-020-024-028-030) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se añaden los signos de convulsión, ataxia y tremor muscular en perros. |
| Librela 5, 10, 15, 20 y 30 mg solución inyectable para perros (EU/2/20/261/001-004-007-010-013) | El apartado 3.5 precauciones especiales para una utilización segura en las especies de destino, y la sección respectiva del prospecto se han modificado con respecto al ejercicio adecuado. En el apartado 3.6 de la ficha técnica y la sección respectiva del prospecto, se añaden polidipsia y poliuria en la frecuencia “rara”, y las reacciones de anafilaxia, inflamación facial, prurito, anemia hemolítica inmunomediada y trombocitopenia inmunomediada en la frecuencia “muy rara”. |
| Loxicom 1.5mg/ml suspensión oral para perros (EU/2/08/090/001) | En el apartado 4.5 de la ficha técnica y 12 del prospecto, se añade la advertencia de no usar en gatos. |
| Isoflo 100% p/p liquido para inhalación de vapor (1385 ESP) | En el apartado 3.5 de la ficha técnica y en el 6 del prospecto, se incluye el párrafo relativo a efectos animales gestantes y mujeres embarazadas. En el mismo apartado, y con relación a las “Precauciones especiales para la protección del medio ambiente, se incluye el párrafo relativo a la utilización de filtros de carbón. |
| Rabigen L (3205 ESP) | En el apartado 4.6 de la ficha técnica y en el 6 del prospecto relativo a reacciones adversas se ha incluido la frase sobre emesis, arrea transitoria, hipertermia o debilidad, así como reacciones de hipersensibilidad en muy raras ocasiones. |
| Lincomay 400 mg/g polvo para administración en agua de bebida (3205 ESP) | En el apartado 3.6 de la ficha técnica y en el 8 de la etiqueta-prospecto se han incluido reacciones de hipersensibilidad en raras ocasiones en pollos y porcino. |
| Cardalis 2.5/20mg, 5/40mg y 10/50mg comprimidos masticables para perros (EU/2/12/142/001, EU/2/12/142/003, EU/2/12/142/005) | En el apartado 4.6 de la ficha técnica y en el 6 del prospecto, se ha añadido a la frecuencia “en muy raras ocasiones” los signos letargia, anorexia, ataxia, falta de coordinación o signos de fatiga, y la frase relativa a perros con insuficiencia renal crónica. |
| Cerenia 16 mg comprimidos para perros; Cerenia 24 mg comprimidos para perros; Cerenia 60 mg comprimidos para perros; Cerenia 160 mg comprimidos para perros; Cerenia10 mg/ml solución inyectable para perros y gatos (EU/2/06/062/001-005) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto relativo a acontecimientos adversos, se ha añadido por razones de farmacovigilancia los desórdenes neurológicos. |
| Versican Plus bb oral liofilizado y disolvente para suspensión oral para perros (3800 ESP) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se añaden, entre paréntesis, los siguientes signos asociados a las reacciones de hipersensibilidad en la frecuencia “muy rara”: anafilaxia, disnea y/o taquipnea, edema facial, urticaria. |
| Ubroseal vacas en secado 2,6 g suspensión intramamaria para bovino (3628 ESP) | En el apartado 3.6. de la ficha técnica y 7 del prospecto, en relación a los acontecimientos adversos, se añade el signo de “mastitis aguda” en frecuencia muy rara. |
| Ivomec Premix (1038 ESP) | En el apartado 4.5 de la ficha técnica y 7 del prospecto, se incluye el párrafo relativo a que las avermectinas no son bien toleradas por algunas especies animales para las que no está autorizado el medicamento (perros, especialmente en collies, pastores ingleses, otras razas semejantes y sus cruces, asi como en tortugas y tórtolas). |
| Entericolix emulsión inyectable para porcino (3382 ESP) | En el apartado 4.6 de la ficha técnica y 6 del prospecto, se añade en la frecuencia “muy rara”: hipersensibilidad incluyendo anafilaxia. |
| Hiprabovis Balance (1907 ESP) | En el apartado 4.6 de la ficha técnica y 6 del prospecto, se añade en la frecuencia “rara”: hipersensibilidad incluyendo anafilaxia. |
| Dolethal (737 ESP) | En el apartado 4.5 de la ficha técnica y 7 del prospecto, se añaden advertencias para las personas que administran el medicamento. |
| Suvaxyn Circo (EU/2/17/223/001) | En el apartado 4.5 de la ficha técnica y en el 12 del prospecto, se incluye la frase “En caso de autoinyección accidental, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta”. |
| Zuprevo 40 mg/ml solución inyectable para porcino (EU/2/11/124/001) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se ha añadido por razones de farmacovigilancia, el signo “anafilaxia” con frecuencia “rara” |
| Equilis te, Equilis prequenza y Equilis prequenza te suspensión inyectable para caballos (EU/2/05/055-056-057/001) | En el apartado 3.6 de la ficha técnica y 7 del prospecto, se han incluido el signo “reacción de hipersensibilidad” en frecuencia “muy rara”, además de la advertencia de anafilaxia (a veces mortal), y administrar sin demora un tratamiento adecuado. |
| Neptra gotas óticas (EU/2/19/246/001) | En el apartado 4.5 de la ficha técnica y 12 del prospecto, se añade lo relativo a que no se ha evaluado la seguridad y eficacia en gatos, y los signos posibles tras su uso en dicha especie no de destino (signos neurológicos, trastornos del oído interno y signos sistémicos), y la recomendación de evitar su uso en gatos. |
| Proteq West Nile suspensión inyectable para caballos (EU/2/11/129/001) | En el apartado 3.6 de la ficha técnica y 7 del prospecto, se añade como signo “absceso en el punto de inyección” en la frecuencia de “muy rara”. |
| Nobivac DP Plus liofilizado y disolvente para suspensión inyectable para perros (cachorros) (EU/2/20/265/001) | En el apartado 3.6 de la ficha técnica y 7 del prospecto, se añade hipersensibilidad incluyendo anafilaxia (a veces mortal), en la frecuencia de “muy rara”. |
| Prolevare 3,6 mg comprimidos recubiertos con película para perros, Prolevare 5,4 mg comprimidos recubiertos con película para perros, Prolevare 16 mg comprimidos recubiertos con película para perros (EU/2/23/295/001–006) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se ha añadido por razones de farmacovigilancia, el signo “convulsiones” con frecuencia “muy rara”. |
| Apoquel 3,6 mg comprimidos recubiertos con película para perros, Apoquel 5,4 mg comprimidos recubiertos con película para perros, Apoquel 16 mg comprimidos recubiertos con película para perros (EU/2/13/154/001-027) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se ha añadido por razones de farmacovigilancia, el signo “convulsiones” con frecuencia “muy rara”. |
| Btvpur suspensión inyectable para ovino y bovino (EU/2/10/113/001-050) | En el apartado 3.6 de la ficha técnica y en el 7 del prospecto, se ha añadido por razones de farmacovigilancia, el signo “reacciones de hipersensibilidad” con frecuencia “muy rara”. |
Hay que tener en cuenta que algunos de los dictámenes iniciales acordados pueden sufrir alguna modificación durante el procedimiento administrativo de implementación, ya que los titulares disponen de un plazo para realizar las alegaciones que estimen convenientes. Del estudio de estas alegaciones pueden derivarse cambios en las modificaciones inicialmente acordadas por el CSMV, que son las que finalmente se introducen en el resumen de características, prospecto y, en su caso, en el etiquetado. El resto de modificaciones de la autorización de comercialización (por adaptación de los textos al nuevo QRD, un total de 92 productos) fueron tratadas en este Comité únicamente para información de sus miembros.
Comité Técnico del Sistema Español de Farmacovigilancia de Medicamentos Veterinarios
El Comité Técnico del Sistema Español de Farmacovigilancia de Medicamentos Veterinarios (CTSEF-VET) es el órgano colegiado de la AEMPS encargado de unificar los criterios de funcionamiento y evaluar las señales de medicamentos veterinarios detectadas por el Sistema Español de Farmacovigilancia de Medicamentos Veterinarios (SEF-VET).
Es importante destacar que cuenta con la participación de todas las comunidades autónomas y de las ciudades autónomas de Ceuta y Melilla.
Se celebró una reunión en 2023, conjuntamente con el CSMV, donde cabe destacar la revisión de las actividades de los distintos agentes en base a las obligaciones recogidas en el documento de buenas prácticas de farmacovigilancia veterinaria, del Sistema Español de Farmacovigilancia Veterinaria. Además, se discutieron los informes preparados por el Departamento de Medicamentos Veterinarios relativos a los procedimientos de detección de señales realizados a nivel europeo y nacional.
Asimismo, se revisaron las estadísticas nacionales de farmacovigilancia veterinaria, las alertas de farmacovigilancia y la situación específica de algunos medicamentos a nivel nacional.
Alertas e informaciones de seguridad no urgente por razones de farmacovigilancia
En el 2023 se decretaron dos alertas por razones de farmacovigilancia respecto al mismo medicamento:
- Alerta de farmacovigilancia de medicamentos veterinarios nº VFCV 1/2023: un lote de Versifel Felv suspensión inyectable para gatos (2636 ESP)
- Alerta de farmacovigilancia de medicamentos veterinarios nº VFCV 2/2023: un lote de Versifel Felv suspensión inyectable para gatos (2636 ESP) y suspensión de la autorización de comercialización
En el 2023 se recibieron y gestionaron, por afectar a medicamentos veterinarios registrados en España, cuatro informaciones de seguridad no urgente (NUIS), una de las cuales fue presentada por España con relación a los riesgos para la fauna silvestre tras el contacto con los cadáveres de animales tratados con pentobarbital sódico.
Alertas por defectos de calidad
En el 2023 se decretaron cuatro alertas por defectos de calidad:
- Alerta por defecto de calidad de medicamentos veterinarios nº VDC 1/2023: dos lotes de de Hipraviar Clon (2243 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDC 2/2023: retirada del mercado de todos los lotes y suspensión de la autorización de comercialización de Clavudale 40 mg/10 mg comprimidos para perros y gatos (2436 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDC 3/2023:un lote de FisioVet solución para perfusión (1162ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDC 4/2023: 1 lote de MAQS ácido fórmico 68.2 g tiras para colmenas de abejas (3031 ESP)
Promoción de la farmacovigilancia veterinaria
La promoción de la farmacovigilancia sigue siendo un punto estratégico para la AEMPS, además de una obligación legal contemplada en las directivas europeas, y en el Real Decreto 1157/2021. Esta prioridad se fundamenta en que la UE considera crucial incrementar los niveles de notificación, por lo que se ha incluido este objetivo en la planificación estratégica del Grupo de Jefes de Agencias de la UE (HMA) y en su Subgrupo de Estrategias de Farmacovigilancia (ESS).
En 2023 se impartieron charlas técnicas destinadas a la formación de futuros veterinarios en las Facultades de Veterinaria de: Barcelona, Cáceres, Córdoba, Madrid (Universidad Alfonso X y Universidad Complutense), Lérida, Murcia, Las Palmas de Gran Canaria, Valencia (Universidad Católica de Valencia y Universidad Cardenal Herrera Oria) y Zaragoza.
Del mismo modo se participó en el Máster de Farmacoepidemiología y Farmacovigilancia organizado por la Universidad de Alcalá de Henares, y en el Máster de Sanidad Animal de la Fundación Vet+i. Igualmente se impartieron algunas charlas en hospitales veterinarios.
Participación en reuniones internacionales
En relación con las actividades de farmacovigilancia a nivel europeo en 2023, cabe destacar la participación en los siguientes grupos y comités: Grupo de Farmacovigilancia Veterinaria del CVMP, P-SMEG, Subgrupo de Terminología VEDDRA, Subgrupo Quality Data, Subgrupo TSM Anaphylaxis in cattle, Subgrupo Dose Factor y Subgrupo ESS de HMA.

