Índice
- ¿QUÉ ES EL SISTEMA ESPAÑOL DE FARMACOVIGILANCIA DE MEDICAMENTOS DE USO HUMANO (SEFV-H)?
- ¿QUÉ NOTIFICAR?
- ¿CÓMO NOTIFICAR?
- REACCIONES ADVERSAS A MEDICAMENTOS
- PREGUNTAS FRECUENTES
- ¿Quién puede notificar?
- ¿Cómo deben de notificar los ciudadanos?
- Con la posibilidad de los ciudadanos de notificar las RAM, ¿deben los profesionales sanitarios seguir notificando sospechas de RAM?
- ¿Debo notificar reacciones de medicamentos no autorizados?
- ¿Debo notificar sospechas de reacciones adversas a medicamentos que se utilicen fuera de las condiciones de autorización (ej. cuando se utiliza el medicamento para una indicación terapéutica que no figura en su ficha técnica autorizada)?
- ¿Debo de tener la certeza de que el medicamento ha causado la reacción? ¿Cómo juzgo la causalidad?
- Si notifico una RAM, ¿me dará más trabajo?
- ¿Cómo se utiliza la información que proporciona la notificación de sospechas de reacciones adversas para mejorar la seguridad de los medicamentos?
- ¿Cómo puedo conocer si una nueva reacción adversa ya ha sido identificada?
- ¿Cómo puedo incorporar datos adicionales relativos a una notificación de RAM, posteriores al envío inicial ya notificado a través de este sistema electrónico?
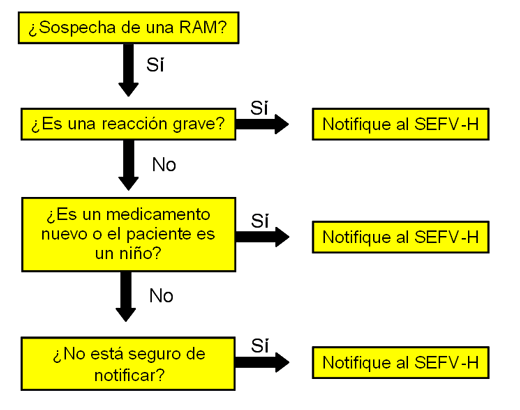
¿QUÉ NOTIFICAR?
Notificar
Por favor, complete el formulario electrónico si usted tiene la sospecha de que un medicamento ha causado una reacción adversa. No se demore en notificar, incluso si aún no tiene la certeza de su causalidad.
Principalmente debe notificar:
- Medicamentos y vacunas sujetos a seguimiento adicional (triángulo negro)
- Sospechas de reacciones adversas graves identificadas con cualquier medicamento, aunque la reacción sea bien conocida. Se entiende como grave aquellas situaciones que:
- Provoquen la muerte.
- Amenacen la vida del paciente.
- Provoquen su hospitalización, o la prolonguen.
- Ocasionen incapacidad laboral o escolar.
- Induzcan defectos congénitos, o
- Sean clínicamente relevantes.
Si no esta seguro de la gravedad de la reacción notifíquelo de igual modo.
Otras áreas de interés específico
-
Las reacciones adversas en niñosDeben notificar todas las sospechas de RAM en niños, con independencia de si el medicamento está aprobado para uso en la población pediátrica. La naturaleza, el curso de la enfermedad y la RAM pueden diferir entre adultos y niños. Las características de la población pediátrica hacen que se recomiende en los casos de RAM graves o las asociadas a vacunas, la notificación aportando datos dentro de lo posible, sobre el peso, la altura y la edad exacta del niño, según las siguientes recomendaciones:
- si ha sido prematuro (gestación de 28 semanas o menos),
- si es neonato (< 28días): indicar la edad en número de ‘días’,
- si es un niño de 28 días a 23 meses: indicar número de ‘meses y días’,
- si es un niño de 2 a 11 años y adolescentes (12 a 18 años): indicar la edad como número de ‘años y meses’.
En general, los niños no forman parte de los ensayos clínicos de los medicamentos, por lo tanto, se conoce menos sobre las posibles reacciones adversas en este grupo de edad. En la Unión Europea, desde 2007, existe regulación específica sobre investigación del uso de los medicamentos en pediatría, con un comité específico en el seno de la Agencia Europea de Medicamentos (EMA, www.ema.europa.eu), el denominado Paediatrician Committee (PDCO).
-
Biológicos y vacunasPor favor, incluya en su notificación el nombre de la marca comercial con la denominación completa indicando el tipo de presentación, (p.e., “nombre del medicamento” jeringa precargadas 0,5ml dosis) ya que puede haber diferentes excipientes según la presentación (vial multidosis o jeringa precargada). También debe proporcionar su número de lote y fecha de caducidad que figura en el envase. En el caso de vacunación con varias dosis, se debe indicar qué dosis se ha administrado en el momento de la reacción adversa (p.ej., segunda dosis de DTa), así como la(s) fecha(s) de las dosis anteriores administradas.
-
Reacciones adversas de los medicamentos a largo plazoAunque estas reacciones adversas son más difíciles de identificar a través de la notificación espontánea, notifique cualquier sospecha de reacción adversa que pueda aparecer meses o incluso años después de la exposición al medicamento, por ejemplo, tipos de cáncer, fibrosis retroperitoneal, etc.
-
Anomalías congénitasSi un bebé nace con una anomalía congénita, o si se produce una malformación del feto durante el embarazo, por favor considere si esto podría ser el resultado de la exposición a un medicamento, y notifíquelo. En la notificación, incluya información sobre cualquier medicamento que se utilizaba durante el embarazo, indicando las fechas o, al menos, en el trimestre cuando utilizó el medicamento, incluyendo la automedicación y la fecha de la última menstruación.
Los medicamentos homeopáticos y medicamentos tradicionales a base de plantasEn la notificación de sospechas de reacciones adversas a estos medicamentos, es importante que nos proporcione tanta información como sea posible, incluida la lista de sus ingredientes, la fuente o el fabricante si se conocen, y la indicación del producto.Tenga en cuenta que también puede notificar sospechas de reacciones adversas que surgen como resultado del error de uso, mal uso, abuso o usos fuera de las indicaciones terapéuticas autorizadas en la ficha técnica del medicamento.
Resumen de qué notificar
CÓMO NOTIFICAR
¿Cómo notificar?
Tiene varios métodos para notificar:
On-line: a través del formulario electrónico al que puede acceder en el siguiente enlace: https://www.notificaRAM.es.
- Mediante correo postal utilizando la tarjeta amarilla del Centro de Farmacovigilancia de la Comunidad Autónoma donde ejerce su profesión. Directorio de Centros Autonómicos del SEFV-H.
¿Qué incluir en la notificación?
Hay cuatro secciones fundamentales de información necesaria en una notificación:
Medicamento(s) sospechoso(s)El nombre del medicamento(s) que se sospecha que ha provocado la reacción. Si se sabe el nombre comercial, se debe comunicar la denominación completa (marca, concentración y presentación).También se debe añadir esta información si se conoce:
- La vía de administración.
- Dosis diaria, frecuencia de dosis y posología.
- Fechas de administración.
- Si se trata de una vacuna u otro medicamento biológico, el nombre de la marca comercial con la denominación completa y su número de lote y fecha de caducidad.
- Reacción(es) adversa(s)Describa la reacción adversa incluyendo el diagnóstico, si procede.Incluya también:
- Cuando se produjo la reacción.
- Gravedad de la reacción.
- Cualquier tratamiento dado.
- Resultado de la reacción.
Si la reacción ya ha sido notificada (por ejemplo, por otro profesional sanitario o el paciente), pero usted tiene información adicional para comunicar, por favor, comuníquenoslo en la notificación para poder identificar la notificación previa y agregar dicha información.
-
Detalles del pacienteLa información básica sobre el paciente es vital en la evaluación de los casos y en la obtención de información adicional. Indique, si es posible, estos campos:
- Sexo del paciente.
- La edad del paciente en el momento de la reacción.
- Si se conoce, indique el peso del paciente.
- Nombre y apellidos del paciente, un número de tarjeta sanitaria o de historia clínica para ayudar a identificar al paciente en cualquier notificación futura.
El intercambio de esta información no infringe acuerdos de confidencialidad entre usted y su paciente ya que la Ley 29/2006 de garantías y uso racional de medicamentos obliga a los profesionales a la notificación en caso de sospechas de RAM.
Puede incluir una copia de esta notificación en la historia clínica del paciente para futuras consultas.
-
Detalles del notificadorEste campo debe ser completado en todos los casos. Por favor, incluya su nombre y correo electrónico para que podamos enviar el acuse de recibo de su notificación y poder contactar con usted para obtener información adicional si fuera necesario. Únicamente, si se notifican RAM asociadas a ‘errores de medicación’ (seleccionando el campo correspondiente), sus datos personales no se admitirán en el formulario. (En las CCAA que disponen de su propio formulario: Andalucía, Canarias y Cataluña, se debe consultar la información al respecto en la página web del Centro Autonómico de Farmacovigilancia).
Otra información adicional
Es muy útil que nos informe de cualquier información adicional que considere relevante, tal como:
- Otros medicamentos utilizados en los últimos tres meses antes de la aparición de la reacción, incluyendo medicamentos con receta, sin receta, publicitarios o medicamentos a base de plantas medicinales.
- Cualquier información sobre re-exposición con el medicamento sospechoso, en otros momentos.
- Antecedentes médicos de interés, incluyendo alergias.
- Resultados de pruebas médicas.
- Para anomalías congénitas, por favor indique todos los demás medicamentos tomados durante el embarazo y la fecha de la última menstruación.
- Puede adjuntar documentos adicionales o informes de pruebas si es necesario, así como imágenes o fotos.
Si el paciente no estaba tomando otros medicamentos, o si no se dispone de otra información, por favor indíquelo.
Toda la información que usted proporcione nos ayudará a interpretar el caso y facilitará su evaluación. Por favor, proporcione toda la información que pueda, pero no se retrase en notificar el caso porque desconozca algunos detalles de la notificación.
Puntos a considerar cuando evalúe la causalidad
No se preocupe si usted tiene dudas sobre el papel que ha jugado el medicamento en la aparición de la reacción adversa. Si tiene la más mínima sospecha de que podría haber una asociación entre los síntomas o signos del paciente y el fármaco, notifique el caso.
Factores que pueden ayudarle a evaluar el papel del medicamento en la aparición de la reacción adversa (RAM):
- Naturaleza de la reacciónAlgunos eventos clínicos generalmente son causados por medicamentos. Por ejemplo:
- Distonías agudas.
- Discrasias sanguíneas.
- Reacciones cutáneas como el síndrome de Stevens-Johnson y necrólisis epidérmica tóxica.
- El síndrome neuroléptico maligno.
- El momento de aparición de la reacciónEl período de tiempo desde el inicio del tratamiento hasta la aparición de la reacción debe ser plausible con la fisiopatología del cuadro clínico. Por ejemplo, las reacciones anafilácticas aparecerán normalmente unos minutos después de la administración parenteral de medicamentos.En casos extremos, algunas reacciones pueden aparecer meses o años más tarde y pueden estar relacionadas a un efecto acumulativo del fármaco o incluso tener un efecto sobre la siguiente generación, por ejemplo la asociación de dietilestilbestrol y cáncer vaginal, que finalmente motivó su retirada del mercado en los años setenta.
- Relación con la dosisLas reacciones adversas a menudo están relacionadas con la dosis y pueden ser minimizadas mediante la reducción de la dosis del medicamento. Si los síntomas desaparecen cuando se suspende el medicamento, esto sugiere que están asociadas al fármaco aunque a veces la resolución de los síntomas también puede ser una coincidencia.Si el medicamento se vuelve a utilizar y reaparecen los síntomas, esto otorga mucho peso a que el medicamento sea el responsable de la aparición de la reacción adversa.
- Otras posibles causasTambién puede ser necesario tener en cuenta otras posibles causas que pueden explicar el cuadro clínico del paciente. Por ejemplo:
- Puede ser una manifestación de la enfermedad subyacente del paciente u otra enfermedad.
- Otros medicamentos (incluyendo la automedicación y las plantas medicinales) que el paciente pueda estar tomando, podrían ser los responsables de la reacción.
- Puede ser debido a una interacción entre dos medicamentos que esté tomando, o incluso con alimentos que tome junto con los medicamentos.
- En algunos casos, los resultados de pruebas médicas pueden ayudar a hacer un diagnóstico, por ejemplo, la medición de las concentraciones plasmáticas del fármaco o los resultados de una biopsia hepática en hepatitis inducida por medicamentos.
Recuerde, si tiene alguna duda, por favor notifique.
REACCIONES ADVERSAS A MEDICAMENTOS
¿Qué es una Reacción Adversa a un medicamento (RAM)?
Una RAM es cualquier respuesta nociva y no intencionada a un medicamento.
No solo incluye efectos nocivos e involuntarios derivados del uso autorizado de un medicamento en dosis normales, sino también relacionados con de errores de medicación y usos al margen de los términos de la autorización de comercialización, incluidos el uso equivocado, la sobredosis y el abuso del medicamento. Términos como efecto secundario, efecto adverso, efecto indeseable, efecto colateral, etc., son sinónimos de RAM.
¿Es la reacción una RAM o un evento adverso?
Las Reacciones adversas y los Eventos adversos no siempre son lo mismo.
Un evento adverso es cualquier suceso indeseable experimentado por un paciente, independientemente de que se sospeche o no del medicamento administrado. Un ejemplo de un evento adverso es un paciente que sufre un accidente de tráfico mientras estaba con un tratamiento farmacológico específico.
Mientras que una reacción adversa (RAM) es cualquier suceso indeseable que ha sucedido con el paciente mientras estaba utilizando un medicamento y existe la sospecha de que es causado por el medicamento. Un ejemplo de una RAM podría ser un paciente que experimenta anafilaxia poco después de tomar el medicamento. Reacciones de tipo A Las reacciones tipo A (“augmented”) son resultado de un aumento en la acción farmacológica del medicamento cuando se administra a la dosis terapéutica habitual. Normalmente son reacciones dosis-dependientes.
Los ejemplos incluyen:
- Presión arterial baja con antihipertensivos.
- La hipoglucemia con insulina.
Las reacciones de tipo A también incluyen aquellos que no están directamente relacionados con la acción farmacológica deseada del fármaco (por ejemplo, boca seca, que se asocia con los antidepresivos tricíclicos, sobreinfecciones por micobacterias en pacientes de artritis reumatoide controlados por infliximab). Reacciones de tipo B Las reacciones de tipo B (“bizarre”) son reacciones que no se esperan de las conocidas acciones farmacológicas del fármaco.
Ejemplos:
- Anafilaxia con penicilina.
- Erupciones cutáneas con antibióticos.
Características de las reacciones Tipo A y Tipo B
| Tipo A | Tipo B |
|---|---|
| Predecibles | No predecibles |
| Normalmente dosis-dependiente | Raramente dosis-dependiente |
| Alta morbilidad | Baja morbilidad |
| Baja mortalidad | Alta mortalidad |
| Responde a una reducción de la dosis | Responde a la retirada del fármaco |
Las RAM de tipo B representan uno de los objetivos principales de la Farmacovigilancia.
¿Cómo identificar RAMs?
Los pacientes pueden comentarle los síntomas que han experimentado desde que utilizaron un nuevo medicamento. Sin embargo, como algunas reacciones adversas pueden no ser evidentes para el paciente, tendrá que estar alerta ante la posible aparición de reacciones adversas.
Otras informaciones que deben valorarse su inclusión:
- Mediciones clínicas anormales (por ejemplo, temperatura, pulso, presión arterial, glucemia, el peso corporal), durante el tratamiento farmacológico.
- Resultados bioquímicos o analíticas anormales durante el tratamiento farmacológico. Por ejemplo, las concentraciones plasmáticas del fármaco o la biopsia hepática en la hepatitis inducida por medicamentos.
- Si se instaura una nueva terapia farmacológica para tratar los síntomas de la RAM.
PREGUNTAS FRECUENTES
Esta sección proporciona información sobre la notificación de sospechas de reacciones adversas a medicamentos (RAM) a los profesionales sanitarios. La información para ciudadanos está disponible en el apartado de los ciudadanos.
- ¿Quién puede notificar?
- Médicos
- Farmacéuticos
- Enfermeros
- Odontólogos
- Podólogos
- Otros profesionales sanitarios, según la Ley 44/2003, de ordenación de las profesiones sanitarias
- Ciudadanos (desde julio 2012)
-
¿Cómo deben de notificar los ciudadanos?Los ciudadanos pueden notificar las sospechas de reacciones adversas a medicamentos bien a través de un profesional sanitario o bien directamente a través del formulario electrónico (https://www.notificaRAM.es). Se recomienda que los ciudadanos notifiquen a través de su médico, farmacéutico u otro profesional sanitario comunicándole los signos o síntomas presuntamente relacionados con medicamentos.
-
Con la posibilidad de los ciudadanos de notificar las RAMs, ¿deben los profesionales sanitarios seguir notificando sospechas de RAM?Sí. Los profesionales sanitarios tienen la obligación de notificar sospechas de reacciones adversas al SEFV-H, siendo esta la vía mayoritaria de notificación. Les pedimos que continúen enviando notificaciones ya que son esenciales para identificar riesgos asociados con los medicamentos. Esta información no puede ser sustituida por las notificaciones de los ciudadanos.
-
¿Debo notificar sospechas de reacciones adversas a medicamentos no autorizados?Si, se deben de notificar las sospechas de reacciones adversas a cualquier medicamento.
-
¿Debo notificar sospechas de reacciones adversas a medicamentos que se utilicen fuera de las condiciones de autorización (ej. cuando se utiliza el medicamento para una indicación terapéutica que no figura en su ficha técnica autorizada)?Sí. Estamos interesados en los efectos adversos de los medicamentos utilizados en la práctica clínica, independientemente de si están o no están siendo utilizados de acuerdo con los términos de la autorización, tal como se describe en la ficha técnica del medicamento.
-
¿Debo tener la certeza de que el medicamento ha causado la reacción? ¿Cómo juzgo la causalidad?No importa si usted no está seguro si una reacción se relaciona con el medicamento que está utilizando el paciente, incluso si sólo tiene la sospecha entonces usted debe notificar. Por favor, no se desanime a notificar simplemente porque no esté seguro de la causalidad.
Para obtener más información sobre cómo evaluar la causalidad por favor consulte nuestra sección de Puntos a considerar cuando evalúe la causalidad .
-
Si notifico una RAM, ¿me dará más trabajo?En algunas ocasiones se le puede pedir que proporcione información adicional de la RAM, con la finalidad de poder valorar convenientemente el caso. Sin embargo, no se solicita información adicional en todas las notificaciones: esto depende del tipo de reacción, del medicamento sospechoso y de cuánta información incluyó en la notificación inicial.
En los medicamentos de origen biológico, es importante que indique el nombre del medicamento y el número de lote del medicamento. Si desconoce estos detalles, por favor indíquelo en la notificación inicial.
-
¿Cómo se utiliza la información que proporciona la notificación de sospechas de reacciones adversas para mejorar la seguridad de los medicamentos?La notificación de sospechas de RAM permitirá identificar nuevas RAM no conocidas, o cambios en el perfil de las RAM ya identificadas en los ensayos clínicos y, en su caso, realizar los cambios necesarios para minimizar los riesgos de los medicamentos.
Esta información se evalúa junto con información procedente de otras fuentes como estudios clínicos, registros, datos procedentes de otras agencias de medicamentos. Con todo ello se toman las medidas necesarias que abarcan desde la retirada del medicamento en casos excepcionales, hasta la inclusión de nueva información en la ficha técnica y prospecto del medicamento. Esta nueva información puede incluir nuevas contraindicaciones, advertencias y precauciones, pruebas de laboratorio para detectar la reacción adversa precozmente u otras acciones encaminadas a minimizar el riesgo, como limitar la prescripción médica a ciertos especialistas, o recomendar su uso como segunda elección. La AEMPS emite Notas informativas sobre cambios relevantes que además de publicar en su web www.aemps.gob.es se distribuyen a través de las Comunidades Autónomas, organizaciones colegiales, sociedades científicas, etc. Actúa en estrecha colaboración con la EMA (Agencia Europea de Medicamentos) y las otras 26 agencias reguladoras de la Unión Europea. También existen los boletines de farmacovigilancia que emite cada Centro Autonómico del SEFV-H.
-
¿Cómo puedo conocer si una nueva reacción adversa ha sido identificada?Los profesionales sanitarios disponen de la Ficha técnica de la gran mayoría de medicamentos en uso. La AEMPS pone a disposición en su página web las fichas técnicas y prospectos actualizados, a través del Centro de Información online de Medicamentos de la AEMPS (CIMA).
Para facilitar la recepción de las Notas informativas, la AEMPS ofrece la suscripción a las listas de distribución, aportando el correo electrónico al que se enviará las notas informativas sobre seguridad, o calidad, bien de medicamentos de uso humano, bien de uso veterinario, o sobre productos sanitarios, cosméticos, o sobre legislación, según seleccione el usuario al suscribirse. También se ofrece el servicio a través de mensajes SMS al teléfono móvil del suscriptor. Recientemente se ha incluido como @AEMPSGOB en la red social Twitter (http://twitter.com/AEMPSGOB) para facilitar el seguimiento de sus noticias.
-
¿Cómo puedo incorporar datos adicionales relativos a una notificación de RAM, posteriores al envío inicial ya notificado a través de este sistema electrónico?En los casos ya notificados por este sistema, si usted necesita modificar o ampliar la información ya enviada, puede hacerlo utilizando el número de referencia que se incluía en el informe de acuse de recibo que se le enviará. Siga las instrucciones que se le indican en la página principal para facilitarle esta tarea.

