Categoría: medicamentos de uso humano, defectos de calidad
Referencia: ICM (CONT), 04/2026
- El laboratorio titular ha informado de un defecto de calidad tras recibir varias reclamaciones relacionadas con un cambio de color y posible obstrucción de la aguja de varias jeringas precargadas de Arixtra
- Este defecto está relacionado con la presencia de una partícula de hierro que se ha oxidado en el interior de la aguja, y podría potencialmente afectar a cualquier lote y presentación del medicamento
- Para evitar los riesgos potenciales del uso de una jeringa afectada, antes de dispensar o administrar este medicamento se debe inspeccionar cuidadosamente para detectar un cambio de color en la base de la aguja, donde se une con el cuerpo de la jeringa
- En caso de detectar este cambio de color, no se debe dispensar/administrar y se debe proceder a su devolución
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha tenido conocimiento, a través del titular de autorización de comercialización del medicamento Arixtra, de un defecto de calidad en la aguja de las jeringas precargadas de este medicamento. El defecto ha sido detectado tras recibir notificaciones relacionadas con una coloración marrón y obstrucción en la aguja de las jeringas precargadas de este medicamento indicado para prevenir que se formen coágulos de sangre en los vasos sanguíneos. La causa de este defecto está relacionada con la presencia de una partícula de hierro que se ha oxidado en el interior de la aguja. Actualmente, la investigación está en curso para identificar la causa raíz e implementar las acciones correctivas y preventivas correspondientes.
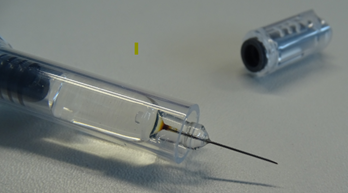
Ejemplo de jeringa con oxidación en la base de la aguja
Se estima que el defecto es muy poco frecuente, no habiéndose recibido ninguna reclamación relacionada con este evento en España, y podría aparecer en cualquier lote de las presentaciones de Arixtra comercializadas en nuestro mercado:
- Arixtra 1.5 mg/0.3 ml solución inyectable, jeringa precargada
- Arixtra 2.5 mg/0.5 ml solución inyectable, jeringa precargada
- Arixtra 5 mg/0.4 ml solución inyectable, jeringa precargada
- Arixtra 7.5 mg/0.6 ml solución inyectable, jeringa precargada
Los riesgos potenciales del uso de una jeringa precargada con presencia de óxido incluyen falta de eficacia por obstrucción de la aguja, reacciones adversas si se administra la inyección afectada (reacciones de hipersensibilidad, complicaciones en el lugar de inyección, incluida rotura de aguja, efectos tromboembólicos e infecciones sistémicas).
Dependiendo de la dosis, Arixtra está indicado para:
- Prevención de eventos tromboembólicos venosos (ETV) en adultos sometidos a cirugía ortopédica mayor de las extremidades inferiores, tal como fractura de cadera, cirugía mayor de rodilla o prótesis de cadera.
- Prevención de ETV en adultos sometidos a cirugía abdominal considerados de alto riesgo de complicaciones tromboembólicas, tales como pacientes sometidos a cirugía abdominal por cáncer.
- Prevención de ETV en pacientes adultos no quirúrgicos inmovilizados considerados de alto riesgo de ETV y que han sido inmovilizados debido a una enfermedad aguda como insuficiencia cardiaca y/o alteraciones respiratorias agudas y/o alteraciones inflamatorias o infecciosas agudas.
- Tratamiento de adultos con trombosis venosa superficial espontánea sintomática aguda de los miembros inferiores sin trombosis venosa profunda concomitante.
- Tratamiento de la angina inestable o del infarto de miocardio sin elevación del segmento ST (AI/IMSEST) en adultos en los que no esté indicada una intervención invasiva (ICP) urgente (< 120 min.).
- Tratamiento del infarto de miocardio con elevación del segmento ST (IMCEST) en pacientes tratados con trombolíticos o que inicialmente no reciban ningún otro tratamiento de reperfusión.
- Tratamiento de adultos con trombosis venosa profunda (TVP) aguda y tratamiento del embolismo pulmonar (EP) agudo, excepto en pacientes hemodinámicamente inestables o en pacientes que requieran trombólisis o embolectomía pulmonar.
Información para profesionales sanitarios
- Inspeccione cuidadosamente las jeringas precargadas de Arixtra previas a su administración para detectar cambio de color en la base de la aguja.
- Si la base de la aguja en la jeringa precargada presenta coloración (como se muestra en la imagen), no administre Arixtra y proceda a su devolución.
- Informe a los pacientes y cuidadores sobre este defecto de calidad y proporcione las precauciones de manipulación, incluida la devolución de cualquier unidad en la que observen el defecto.
Información para farmacias
- Inspeccione cuidadosamente las jeringas precargadas de Arixtra que vaya a dispensar para detectar cambio de color en la base de la aguja.
- En caso de detectar alguna unidad afectada, deben proceder a su devolución a la compañía por los cauces habituales, informando del defecto para que puedan proceder a su sustitución.
Datos de la empresa
Viatris Pharmaceuticals, S.L.
(+34) 900 102 712
Correo electrónico para notificar defectos de calidad: cliente@viatris.com, ReclamacionesQA.Spain@viatris.com
Correo electrónico para notificar sospechas de reacciones adversas: phvg.spain@viatris.com
Si tiene conocimiento de alguna reacción adversa relacionada con el uso de un medicamento, notifíquelo a través del portal NotificaRAM. Su colaboración notificando es esencial para tener un mayor conocimiento de estos productos y velar por su seguridad. Asimismo, se informa de los puntos de contacto en las comunidades autónomas para la notificación de incidencias y alertas de calidad.

