Índice
- Nombre del medicamento
- Principio activo
- Composición / Excipientes
- Vía de administración / Forma farmacéutica
- Símbolos, siglas y leyendas
- Otras leyendas aplicables
- Condiciones especiales de conservación
- Titular de la autorización de comercialización/ Representante local
- Dispositivos de seguridad
- Blue Box
- Códigos QR
- Pictogramas y otros elementos
Nombre del medicamento
El nombre de los medicamentos es un elemento identificativo de relevancia. Forma parte de las garantías de identificación de los mismos, tal y como recoge la legislación vigente en diferentes disposiciones, de tal forma que reseñe correctamente el medicamento y no induzca a error o confusión con otros medicamentos u otro tipo de productos, o en cuanto a sus propiedades.
El nombre completo, es decir, ‘nombre (de fantasía) + dosis + forma farmacéutica’, debe presentarse en el etiquetado como una unidad visual en la cara principal, en la medida de lo posible.
Cuando se trate de monofármacos, se intentará, cuando sea posible, que la dosis vaya incluida justo a continuación del nombre del medicamento y no en la siguiente línea.
Es recomendable que el nombre completo del medicamento figure, al menos, en tres caras no consecutivas del embalaje exterior.
La dosis en el nombre del medicamento se debe expresar siguiendo las recomendaciones del grupo QRD recogidas en documento “Recommendations on the expression of strength, November 2009”.
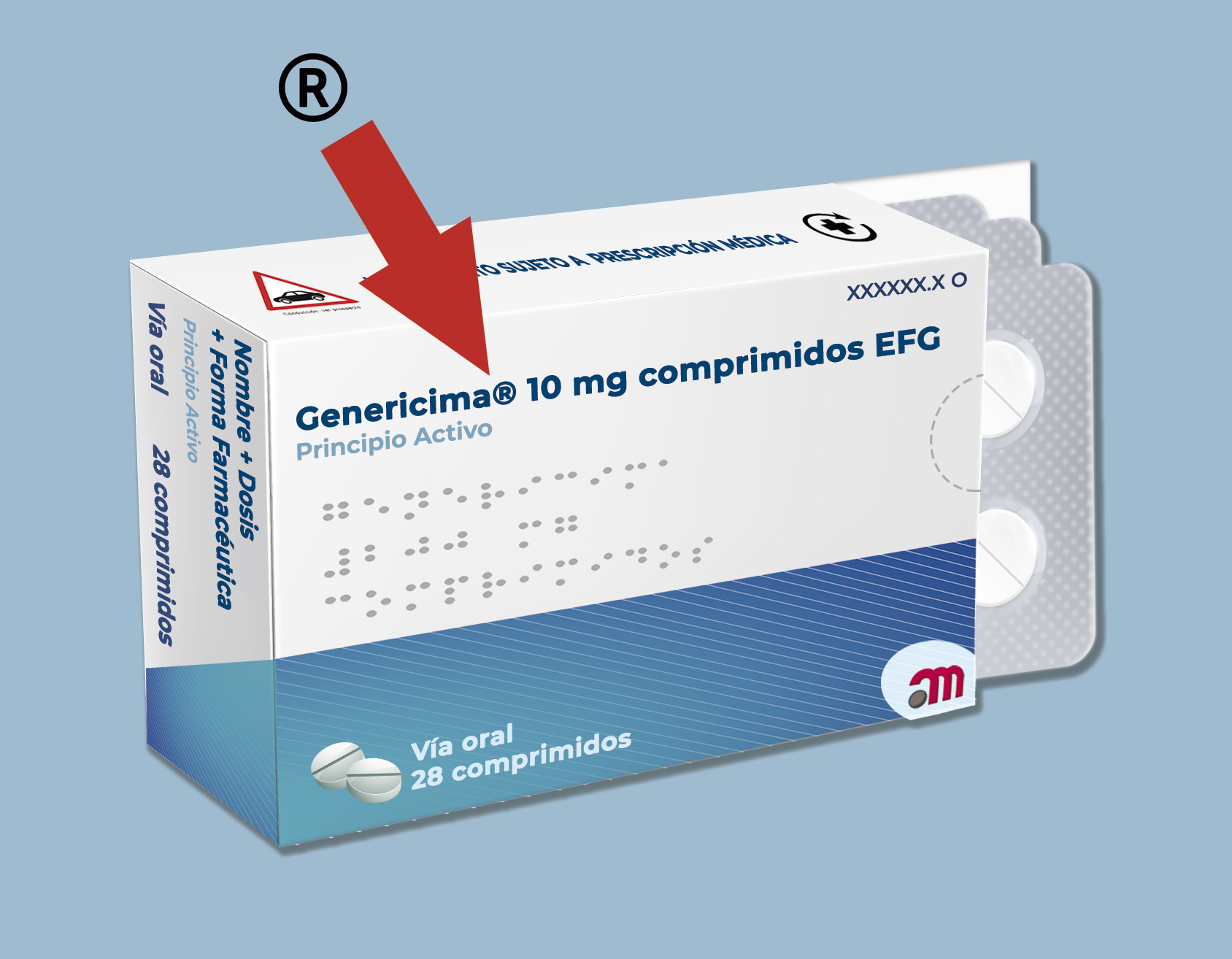
Solamente en los medicamentos genéricos solicitados con dicha base legal se incluirán las siglas EFG al final del nombre del medicamento.
El nombre del medicamento también deberá indicarse en alfabeto braille en el embalaje exterior o, en su ausencia, en el acondicionamiento primario, teniendo en cuenta las particularidades de cada medicamento. De forma excepcional, no es necesario incluirlo en aquellos medicamentos que requieran de forma imprescindible la administración por un profesional sanitario (vacunas inyectables y otros medicamentos de administración parenteral no autoinyectables).
Principio(s) activo(s)
El medicamento se compone de principios activos y excipientes. El principio activo es el componente responsable de la actividad del medicamento.
- El nombre del (los) principio(s) activo(s)debe incluirse debajo del nombre del medicamento.
- No es obligatorio en caso de denominación genérica (salvo cuando la dosis se corresponde con la sal, no incluida en el nombre).
- Si corresponde a una sal, destacar la base frente a su sal: Ej.: Diltiazem, hidrocloruro.
- Referencia al principio activo: dosis X expresada en el nombre del medicamento.
- Si la dosis se refiere a la base (X mg de base por dosis): indicar la base debajo del nombre.
- Si la dosis se refiere a la sal (X mg de sal por dosis): indicar la sal debajo del nombre.
Composición / Excipientes
El medicamento se compone de principios activos y excipientes.
El principio activo es el componente que produce el efecto del medicamento.
Es recomendable la inclusión del contenido total en la cara principal cuando sea relevante para la correcta administración del medicamento (por ejemplo, contenido total del principio activo en el volumen total de medicamento en inyectables).
Los excipientes son toda sustancia inerte que se mezcla con principio(s) activo(s) para conformar los medicamentos y así darles consistencia, forma, sabor u otras cualidades que faciliten su dosificación y uso.
En el etiquetado de los medicamentos de administración por vía parenteral, tópica u oftalmológica se deben especificar todos los excipientes incluidos en su composición. Entre los medicamentos de administración tópica se incluyen aquellos que se aplican externamente sobre la piel (incluyendo los parches transdérmicos), los que se administran por vía inhalatoria y cualquier otro aplicado en la mucosa del oído, oral, nasal, rectal o vaginal (esto es, donde la acción pueda ser local, o a través de la piel o de las mucosas).
Para todos los demás medicamentos, en el etiquetado solo se deben declarar aquellos excipientes que tengan una acción o efecto reconocidos. A continuación, se debe añadir la leyenda: “Para mayor información, consultar el prospecto”.
En el caso de que el medicamento contenga excipientes procedentes de almidón de maíz o almidón de patata o sus derivados, sólo es necesario declarar la planta de la que procede el almidón en la sección 6 (composición) del prospecto, con el fin de informar de que estos excipientes no proceden del trigo y son aptos para pacientes celíacos o con alergia al trigo.
Más información:
Vía de administración / Tamaño de envase y forma farmacéutica
La vía de administración es el lugar o sitio a través del cual se introduce el medicamento en el organismo (ej. vía oral, intramuscular, intravenosa, rectal, etcétera). Deberá aparecer preferiblemente en la cara principal.
La forma farmacéutica es la disposición en la que se formulan los principios activos y excipientes para constituir el medicamento. Ej. comprimido, comprimido recubierto con película, cápsulas blandas, cápsulas duras, polvo para suspensión oral, solución inyectable, etcétera.
Tanto para la forma farmacéutica como para la vía de administración, se utilizarán los standard terms vigentes.
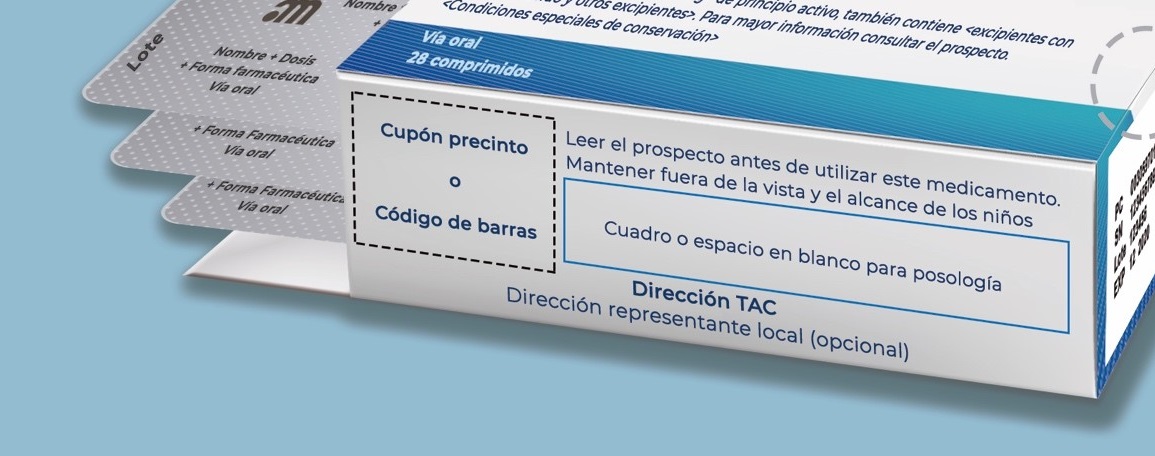
Símbolos, siglas y leyendas
Los símbolos, siglas y leyendas son elementos de relevancia que se encuentran en el etiquetado y aportan información sobre el medicamento.
Deberán situarse en el margen superior derecho de las dos caras principales del embalaje exterior junto al código nacional (XXXXXX.X). Este es un elemento fundamental para la identificación del formato de un medicamento.
| Significado de los símbolos | SÍMBOLOS |
|---|---|
| Dispensación sujeta a prescripción médica | |
| Dispensación con receta oficial de estupefacientes de la lista I | |
| Psicótropos del anexo I | |
| Psicótropos del anexo II | |
| Conservación en frigorífico |
| Significado de las siglas | SIGLAS |
|---|---|
| Uso hospitalario | H |
| Diagnóstico hospitalario | DH |
| Medicamento tradicional a base de plantas | MTP |
| Tratamiento de larga duración (Solo aplicable a medicamentos que ya tenían esa calificación y sus genéricos) |
TLD |
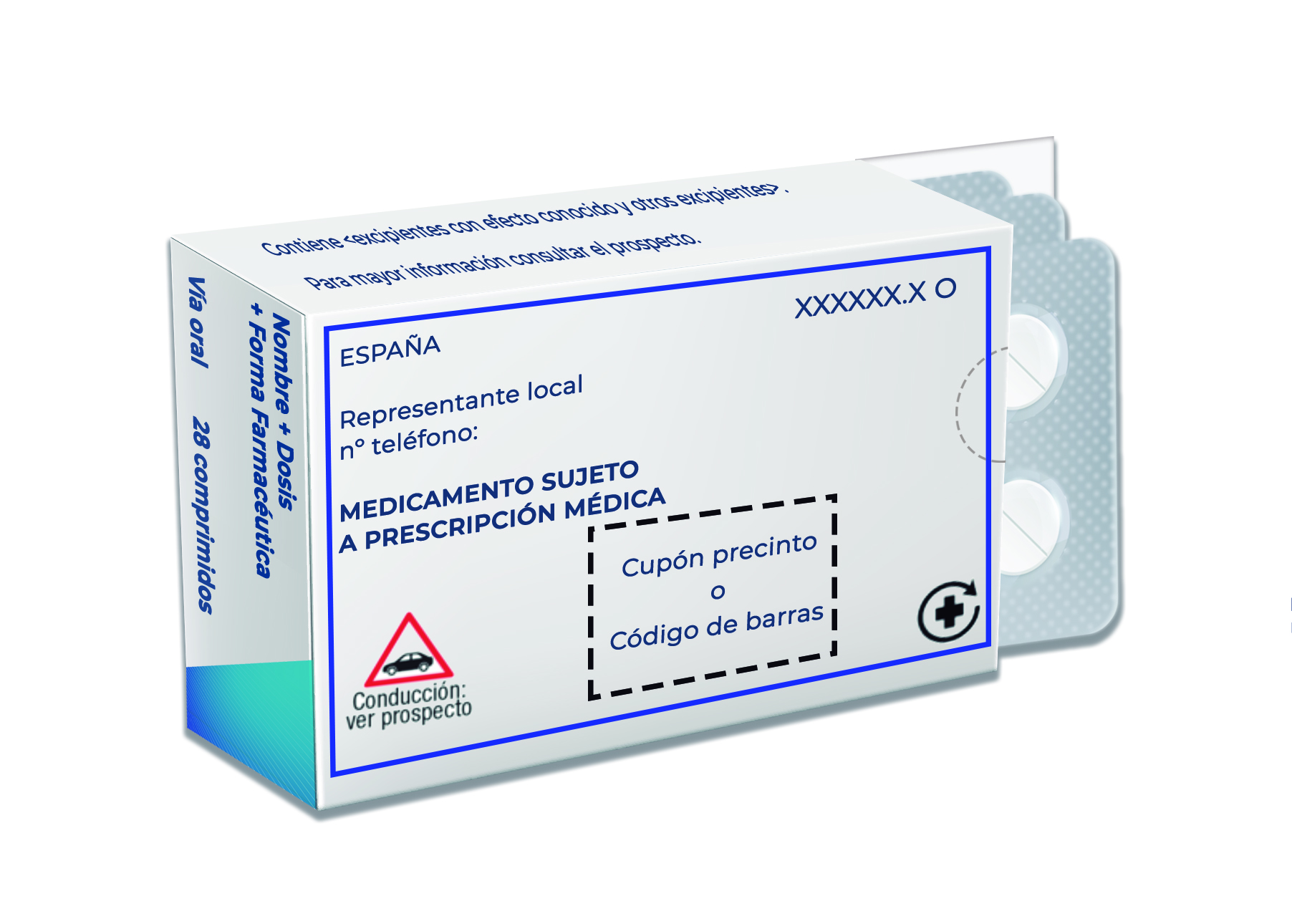
En aquellos medicamentos sujetos a prescripción médica y que están financiados por el SNS, se incluirá el cupón precinto.
Otras leyendas aplicables
- MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
- Medicamento no sujeto a prescripción médica
- Uso hospitalario
- Diagnóstico hospitalario
- Leer el prospecto antes de utilizar este medicamento
- Mantener fuera de la vista y del alcance de los niños
- Envase clínico, prohibida su venta al detalle
- Medicamento homeopático
- Basado exclusivamente en su uso tradicional
- Muestra gratuita, prohibida su venta
Pueden incluirse todas aquellas advertencias especiales que el medicamento requiera.
Debe figurar la indicación terapéutica y población diana (solo para medicamentos no sujetos a prescripción médica).
Condiciones especiales de conservación
Las condiciones especiales de conservación son aquellas medidas concretas que tiene un medicamento para su correcto almacenaje.
Las frases estándar de las condiciones especiales de conservación se encuentran en el Apéndice III del QRD template:
<No conservar a temperatura superior a <25°C> <30°C>>
<Conservar por debajo de <25ºC> <30ºC>>
<Conservar en nevera>
<Conservar y transportar refrigerado>*
<Conservar en congelador>
<Conservar y transportar congelado>**
<No <refrigerar> <o> <congelar>>
<Conservar en <el embalaje> original>****
<Mantener {el envase}*** perfectamente cerrado>****
<Conservar {el envase}*** en el embalaje exterior>****
<para protegerlo de la <luz> <humedad>>
* The stability data generated at 25°C/60%RH (acc) should be taken into account when deciding whether or not transport under refrigeration is necessary. The statement should only be used in exceptional cases.
** The statement should be used only when critical.
*** The actual name of the container should be used (e.g. bottle, blister, etc.)
**** It should be specified if the product is sensitive to light and/or moisture.
***** Depending on the pharmaceutical form and the properties of the product, there may be a risk of deterioration due to physical changes if subjected to low temperatures. Low temperatures may also have an effect on the packaging in certain cases. An additional statement may be necessary to take account of this possibility.
Titular de la autorización de comercialización /Representante local
Titular de la autorización de comercialización (TAC): es la persona física o jurídica responsable de la comercialización del medicamento para el que se ha obtenido la preceptiva autorización de comercialización.
Incluir nombre y dirección. Opcionalmente, teléfono, fax y/o email corporativo.
Por motivos de espacio, está permitido incluir únicamente el logo o el nombre completo del TAC en acondicionamientos primarios, siempre y cuando el logo sea lo suficientemente identificativo como para sustituir el nombre del TAC (por ej. logos que incluyan el nombre del TAC en su diseño).
No se acepta la inclusión de logos que no proporcionen información útil para el paciente (símbolos o pictogramas no identificativos del TAC).
Representante local: en algunos casos, el TAC puede designar un representante local en España.
La información mínima obligatoria a incluir es el nombre. Es recomendable añadir el teléfono y la dirección postal.
La inclusión del logo del representante local tendrá carácter voluntario, si bien este logo se podrá incluir una sola vez, siempre que no afecte a la legibilidad. Se ubicará al lado o debajo del nombre del representante local.
- En aquellos casos en que existan las dos figuras (TAC y representante local), se incluirá al menos el encabezado “Representante local” delante de la información correspondiente. Si fuera posible, se incluirá también el encabezado “Titular de la autorización” para poder diferenciarlos de forma clara.
Dispositivos de seguridad / lote y caducidad
El sistema de dispositivos de seguridad tiene por objeto reforzar la cadena legal frente a los medicamentos falsificados.
Incluyen dos elementos en el embalaje exterior de los medicamentos:
- Identificador único: una secuencia única incluida en un código de barras bidimensional que permite la identificación y verificación de la autenticidad del envase individual en el que se encuentra impreso.
- Dispositivo contra las manipulaciones: permite verificar si el envase del medicamento ha sido manipulado.
El Reglamento Delegado (UE) 2016/161 de la Comisión establece las disposiciones detalladas relativas a los dispositivos de seguridad [identificador único (IU) y dispositivo contra manipulaciones (DCM)] que deben figurar en el envase de determinados medicamentos de uso humano.
Lote y caducidad: todos los medicamentos deben incluir esta información con caracteres visuales.
Los medicamentos con una estabilidad reducida después de su reconstitución, dilución o apertura indicarán el tiempo de validez de la preparación reconstituida, diluida o tras su apertura e incluirán un recuadro para su consignación por los usuarios.
En los medicamentos que contengan radionucleidos, se expresará día/mes/año y, en su caso, hora, minutos y país de la referencia horaria.
‘Blue box’
La blue box, aplicable solo para los medicamentos aprobados por procedimiento centralizado, es un recuadro que contiene la información requerida en el ámbito nacional que se detalla a continuación:
- ESPAÑA, sin negrita.
- Nombre del representante local y teléfono, debajo de ESPAÑA (procurando dejar una separación entre ESPAÑA y los datos del representante local para favorecer la legibilidad).
- La leyenda sobre las condiciones de prescripción, así como cualquier otra que corresponda añadir para el medicamento en cuestión, se incluirán preferiblemente a continuación de la información del representante local.
- Código Nacional: incluir el número sin las siglas CN, seguido de las siglas relativas a las condiciones de prescripción y dispensación, según proceda, y los símbolos aplicables.
- El símbolo correspondiente al sistema de recogida de residuos de medicamentos (ej. SIGRE), cuando aplique, se debe incluir en la parte inferior de la blue box. No será necesario en el caso de medicamentos de uso hospitalario.
- La inclusión del nombre completo del medicamento (incluyendo las siglas EFG, cuando corresponda) será voluntaria.
- La distribución de la información debe hacerse en el mismo sentido de lectura que la del resto del cartonaje.
- Incluir el pictograma de la conducción en los medicamentos que corresponda.
- En caso de medicamentos genéricos, incluir la leyenda “Medicamento genérico: EFG”.
Con el fin de armonizar, en la medida de lo posible, el diseño de la blue box, es conveniente seguir las siguientes recomendaciones (ver ejemplo a continuación):
Códigos QR
Es posible incluir códigos QR, diferentes a los utilizados en los dispositivos de seguridad, para proporcionar información sobre el medicamento. Su inclusión se puede solicitar para medicamentos que se vayan a autorizar o en medicamentos ya autorizados.
Para ello se deben seguir las siguientes recomendaciones, dependiendo del procedimiento de autorización:
Pictogramas y otros elementos
- Pictograma de la conducción: el objetivo del símbolo es llamar la atención del usuario para que lea en el prospecto la información correspondiente. Los prospectos de los medicamentos contienen la advertencia de los efectos que pueden tener en quienes conducen o manejan maquinaria peligrosa.
- Otros pictogramas de interés
Símbolo SIGRE: indica que el laboratorio fabricante está adherido a SIGRE, único sistema integrado de gestión de medicamentos autorizado en España por las autoridades sanitarias y medioambientales. Garantiza que tanto los envases como los residuos de medicamentos que puedan contener van a recibir un tratamiento medioambiental adecuado, una vez que el ciudadano los deposita en el Punto SIGRE.
No sería aplicable a medicamentos de uso hospitalario.
- Partes del cuerpo en medicamentos no sujetos a prescripción médica, para facilitar la comprensión por parte el paciente del órgano al que va dirigido o su vía de administración. Su inclusión es voluntaria.
- Tabla posología, en aquellos casos en los que sea aplicable. Su inclusión es voluntaria.
- Símbolo marca registrada, solo aplicable a maquetas:
- Pictograma de la forma farmacéutica real, para una mejor identificación por parte del farmacéutico y del paciente. Su inclusión es voluntaria.
- Logo de certificación de uso de papel reciclado en el cartonaje: se recomienda que solo figure en solapas interiores del etiquetado, siempre y cuando sea de un tamaño razonable y sin inducir ningún tipo de publicidad, con el objeto de garantizar un uso racional del medicamento. Su inclusión es voluntaria.