Última actualización: 30/10/2012
Puede consultar esta nota en formato pdfFIRMA ELECTRÓNICA DE RESOLUCIONES RELATIVAS AL PROCEDIMIENTO DE AUTORIZACIÓN DE UN ENSAYO CLÍNICO CON MEDICAMENTOS
Fecha de publicación: 30 de octubre de 2012 Categoría: AEMPS, MEDICAMENTOS DE USO HUMANO, INVESTIGACIÓN CLÍNICA. Referencia: MUH, 15/2012
La AEMPS, en línea con el proceso de implantación de la administración electrónica en todos sus procedimientos, comenzará a aplicar la firma y notificación electrónica de las resoluciones a las solicitudes de autorización de ensayos clínicos recibidas a partir del 5 de noviembre de 2012.
La AEMPS, en línea con el proceso de implantación de la administración electrónica en todos sus procedimientos, comenzará a aplicar a partir del 5 de noviembre de 2012 la firma y notificación electrónica de las resoluciones referentes a solicitudes de autorización de ensayos clínicos tramitadas conforme al Real Decreto 223/2004, así como de los demás documentos y oficios
relacionados con este trámite (ver apartado de esta nota procedimiento de autorización de un ensayo clínico). Este procedimiento se aplicará a las solicitudes recibidas desde el 5 de noviembre de 2012.
Esto significa que el promotor del ensayo clínico (EC) recibirá en la dirección de correo electrónico indicada para el solicitante en la sección C.1.4 del formulario de solicitud los documentos correspondientes en formato PDF firmados electrónicamente. La firma se hará haciendo uso del certificado de sello electrónico de la AEMPS.
Los documentos firmados electrónicamente pueden consultarse en la web de la AEMPS https://sede.aemps.gob.es/ a partir del localizador que figura al pie de cada página (figura 1). Realizando esta consulta puede comprobarse la autenticidad del documento. También se puede acceder a la aplicación directamente en la siguiente dirección: https://localizador.aemps.es/
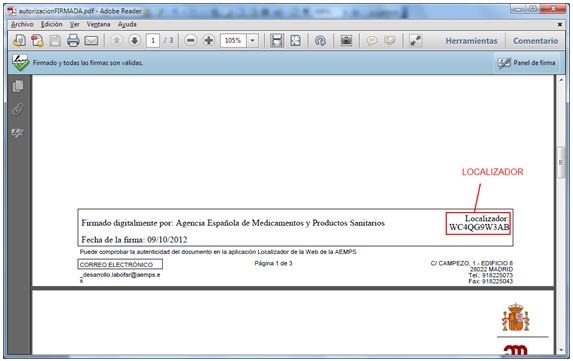 Fig.1
Fig.1
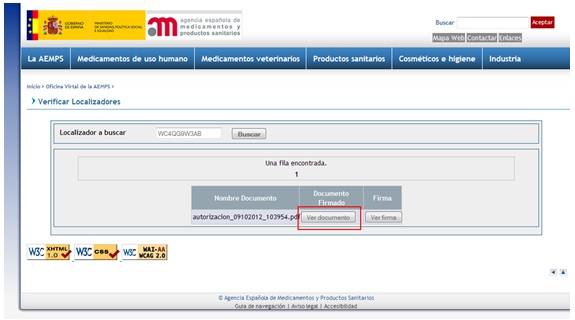 Fig.2
Fig.2
Base legal
Este nuevo procedimiento de firma de documentos se apoya en las siguientes disposiciones legales: Ley 59/2003, de 19 de diciembre, de firma electrónica. Ley 11/2007, de 22 de junio, de acceso electrónico de los ciudadanos a los Servicios Públicos. Real Decreto 1671/2009, de 6 de noviembre, por el que se desarrolla parcialmente la Ley 11/2007, de 22 de junio, de acceso electrónico de los ciudadanos a los servicios públicos. Resolución de 10 de octubre de 2011, de la Subsecretaría de Sanidad, Política Social e Igualdad, por la que se regula la utilización de un sistema de código seguro de verificación en los documentos emitidos por los procedimientos automatizados de la Agencia Española de Medicamentos y Productos Sanitarios (https://sede.msps.gob.es/sobreSede/docs/resolucionCSVAEMPS.pdf). Resolución de 10 de octubre de 2011, de la Subsecretaría del Ministerio de Sanidad, Política Social e Igualdad, por la que se crean sellos electrónicos de la Agencia Española de Medicamentos y Productos Sanitarios (https://sede.msps.gob.es/sobreSede/docs/resolucionSellosAEMPS.pdf).Procedimiento de autorización de un ensayo clínico
Una vez recibida en la AEMPS una solicitud de autorización de un EC, y en el plazo máximo de 10 días naturales se comunicará por e-mail al solicitante que la solicitud ha sido admitida a trámite indicando como fecha de inicio del calendario de evaluación la fecha en que se ha notificado que la solicitud es válida (escrito de validación), o en su caso, una petición de subsanación indicando los motivos por los cuales no es posible la aceptación de la solicitud. Cuando se solicita una subsanación el promotor tiene 10 días naturales para responder. En caso de no recibir respuesta en el plazo establecido la AEMPS emitirá una resolución de desistimiento de la solicitud. Durante el periodo de evaluación podrá solicitarse información adicional (solicitud de aclaraciones) en el caso de que los documentos recibidos no contengan la información necesaria, o emitir una propuesta de denegación en la que se recojan las objeciones de la AEMPS. Cuando se solicitan aclaraciones por parte de la AEMPS el promotor dispondrá de 15 días naturales para contestar. En caso de no recibir respuesta a una solicitud de aclaraciones, o cuando la respuesta no sea satisfactoria se emitirá una propuesta de denegación. La propuesta de denegación contiene los motivos de dicha propuesta y el promotor dispone de 15 días naturales para presentar alegaciones. En ausencia de alegaciones a una propuesta de denegación, se emitirá una resolución de denegación de la solicitud. Cuando el promotor presente alegaciones a la propuesta de denegación, la AEMPS las evaluará y resolverá en consecuencia. Excepcionalmente cuando se solicite de manera justificada se podrá conceder una ampliación en el plazo para contestar a la propuesta de denegación. De acuerdo con lo previsto en el artículo 23 del RD 223/2004, no podrá iniciarse ningún EC sin la previa autorización por escrito de la AEMPS en los siguientes casos:- EC en los que la AEMPS haya comunicado objeciones al promotor dentro del plazo establecido en el calendario de evaluación notificado.
- EC con medicamentos que requieren o disponen de la calificación de PEI.
- EC con Medicamentos de Terapia Avanzada, incluidos los de terapia celular xenogénica, así como con medicamentos que contengan organismos modificados genéticamente.

