Información dirigida a profesionales sanitarios
Índice
- Introducción
- Notificaciones individuales de sospechas de acontecimeinetos adversos (AA)
- Informes periódicos de seguridad (IPS) y estudios posautorizacion
- Procedimientos centralizados, descentralizados y de reconocimeinto mutuo
- Comité de seguridad de medicamentos veterinaniors (CSMV)
- Comité técnico del sistema español de farmacovigilancia de medicamentos veterinarios (CTSEF-VET)
- Alertas e informaciones de seguridad no urgente (NUIS) por razones de farmacovigilancia
- Alertas por defectos de calidad
- Promoción de la farmacovigilancia veterinaria
- Participación en reuniones internacionales
Introducción
Pese a la extensa información provista para garantizar la calidad, seguridad y eficacia durante la solicitud de registro solo es posible contar con un conocimiento completo del comportamiento de los medicamentos veterinarios una vez que se han registrado. Es en estas condiciones reales de uso, en las que el medicamento veterinario (MV) se administra en ocasiones a especies animales de destino no autorizadas (en base a los preceptos legales de prescripción excepcional), se utiliza en las diferentes razas de cada especie, en diversas condiciones de manejo, a animales con patologías concomitantes o que reciben tratamientos con más de un medicamento (circunstancia bastante común en el ámbito veterinario), etc., cuando pueden aparecer problemas de eficacia o de seguridad novedosos que pueden ser relevantes. Por otra parte, una vez registrado el MV su uso normalmente alcanza a miles de animales y solo entonces pueden dar la cara reacciones que tengan una incidencia muy baja y que no se han observado en los estudios preclínicos y clínicos.
Es aquí donde cobra importancia la actividad de Salud Pública que tiene por objeto la identificación, cuantificación, evaluación y prevención de los riesgos del uso de los medicamentos una vez comercializados, permitiendo así el seguimiento de los posibles efectos adversos de los medicamentos, o lo que es lo mismo, Farmacovigilancia (Real Decreto Legislativo 1/2015, de Garantías y Uso racional de Medicamentos y Productos Sanitarios, Art. 53), y es por ello que se creó el Sistema Español de Farmacovigilancia de Medicamentos Veterinarios (mediante el Real Decreto 1275/2011) buscando confirmar si el balance Beneficio/Riesgo (B/R) del uso de los medicamentos veterinarios (MV) se mantiene dentro de los márgenes conocidos cuando se autorizó su comercialización, identificando si hay nuevos riesgos o si la gravedad y/o frecuencia de los riesgos ya conocidos ha variado significativamente y, en base a ello, instaurar medidas para evitar o minimizar sus consecuencias y poder así gestionar adecuadamente los riesgos para la salud pública, la sanidad animal y el medio ambiente.
Para el funcionamiento de este Sistema es imprescindible la participación activa de los profesionales sanitarios, muy especialmente de los veterinarios, dado que se nutre de las notificaciones realizadas por los mismos.
Es importante recordar que el hecho de que se observen acontecimientos adversos (AA) a un MV no debe ser considerado como algo extraordinario, ya que no hay ningún MV que sea totalmente inocuo o esté exento de poder causar reacciones, ni ningún MV que sea 100% eficaz. De ahí la necesidad de implementar un sistema de FV y una evaluación técnica del balance B/R, para aportar a todos los interesados (profesionales sanitarios, ganaderos, propietarios de los animales y usuarios en general) la mejor información que ayude a tomar las mejores decisiones de tratamiento en cada momento.
Conforme establece la legislación europea, la FV cubre toda una serie de situaciones (más amplias que las que se contemplan en la Farmacovigilancia de medicamentos de uso humano), incluyendo aspectos de seguridad y eficacia en los animales de destino, de seguridad en las personas que manipulan los MV o que entran en contacto con los animales a los que se les ha administrado el MV, en los consumidores de alimentos de origen animal (los problemas derivados de unos residuos mayores que los Límites Máximos de Residuos –LMR– aprobados en la UE) con las consiguientes repercusiones en la salud pública, así como problemas medioambientales. De forma global, pueden considerarse como Sospechas de Acontecimientos Adversos (SAA) los siguientes casos:
- Sospechas de reacciones adversas (RA) en animales en condiciones normales de empleo del MV, es decir, cuando su empleo es conforme con su autorización de comercialización y, por tanto, en línea con lo establecido en la Ficha Técnica.
- RA tras el “uso no contemplado”, siendo éste el que corresponde a cualquier variación respecto a lo establecido en la autorización del MV.
- Sospecha de Falta de la Eficacia esperada.
- Insuficiencia de los Tiempos de Espera. La responsabilidad de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) es garantizar que si se respeta el tiempo de espera fijado en la autorización no aparecerán residuos por encima de los LMR en los alimentos de origen animal obtenidos de los animales tratados. De no ser así, se podría solicitar al Titular la correspondiente variación para aumentar el tiempo de espera.
- Reacciones en personas, que se pueden producir durante la administración del producto a los animales, contacto con el mismo, inyecciones accidentales, etc.
- Problemas medioambientales, consecuencia de los tratamientos administrados a los animales, y por último
- Transmisión de Agentes Infecciosos consecuencia de tratamientos con MV.
Las principales actividades que se llevan a cabo en el Departamento de Medicamentos Veterinarios (DMV) son la gestión y evaluación de las notificaciones individuales de AA (ya sean comunicadas por profesionales sanitarios, Titulares, propietarios de animales o ganaderos), así como dos tipos de informaciones que aportan en exclusiva los Titulares y que son: los Informes Periódicos de Seguridad (IPS), que aportan una actualización periódica de seguridad a nivel mundial, y los Sistemas de Farmacovigilancia (SFV), en los que describen cómo llevan a cabo las tareas principales de Farmacovigilancia. Como consecuencia de toda esta labor, el Área de Farmacovigilancia Veterinaria es responsable de proponer la instauración de medidas reguladoras como son: Obligar a los Titulares a presentar variaciones de seguridad, la solicitud de estudios post-autorización o, incluso, si el desequilibrio en el balance B/R no se pudiera corregir de manera efectiva, proponer la suspensión o la revocación definitiva de la autorización, decretando en estos supuestos una alerta.
Asimismo, el Área evalúa y gestiona las Alertas de FV y las notificaciones europeas no urgentes (NUIS) a nivel nacional e internacional, que son publicadas posteriormente en la Web de la AEMPS, y el seguimiento y control de las medidas reguladores instauradas sobre las autorizaciones de los MV afectados en las alertas.
Por último, también se llevan a cabo de forma periódica los análisis de Detección de Señales de los medicamentos veterinarios autorizados por procedimiento centralizado de los que somos ponentes. Para ello, se utiliza el repositorio unificado (Data Warehouse) que permite realizar búsquedas en la base de datos europea (EVVET), donde se accede a todas las AA que se hayan notificado, ocurridas tanto en la UE como en países terceros.
El presente boletín recoge las actividades de FV llevadas a cabo por la AEMPS a través del DMV, siendo una herramienta básica de comunicación entre todos los implicados en general y, especialmente para los veterinarios, sobre la vigilancia continua de la eficacia y seguridad de los MV.
Notificaciones individuales de sospechas de acontecimientos adversos (AA)
La notificación o comunicación de un AA a un MV es obligatoria conforme la legislación nacional tanto para los profesionales sanitarios como para los Titulares. Para armonizar y simplificar estas notificaciones en la UE, la red de agencias europeas de MV elaboró dos formularios, uno de uso por profesionales sanitarios (https://www.aemps.gob.es/vigilancia/medicamentosVeterinarios/docs/formulario_tarjeta_verde.doc) y otro para los Titulares, que están disponibles en la Web de la AEMPS (www.aemps.gob.es). Complementariamente, la AEMPS ha editado en papel el formulario de uso por profesionales sanitarios, conocido como Tarjeta Verde, y que ya viene preparado para su envío directo a la AEMPS y para ser franqueada en destino. Con independencia de lo anterior, ambos formularios se han incorporado a la base de datos nacional de FV (“VIGÍA-VET”), a la que tienen acceso los Titulares y los profesionales sanitarios a través de Internet, previo registro.
La AEMPS recibe las AA de los Titulares, de los profesionales sanitarios y de los ganaderos y propietarios de los animales, bien electrónicamente (a través de VIGÍA-VET o de la base de datos europea conocida como Eudravigilance Veterinaria (EVVET)) o bien en soporte papel (admisible para todos ellos pero sólo en circunstancias excepcionales permitido para la industria). Además, se ha facilitado un módulo en la aplicación de prescripción del Consejo General de Colegios Veterinarios (Prescrivet) así como en la aplicación del Consejo General de Colegios de Veterinarios de Andalucía (Recevet) para poder notificar estos casos directamente desde el móvil.
El número de notificaciones de AA en España en 2020 alcanzó las 1.941. De ellas 1.510 AA fueron casos notificados por primera vez, y el resto seguimientos que aportaban una mayor información sobre casos notificados previamente.
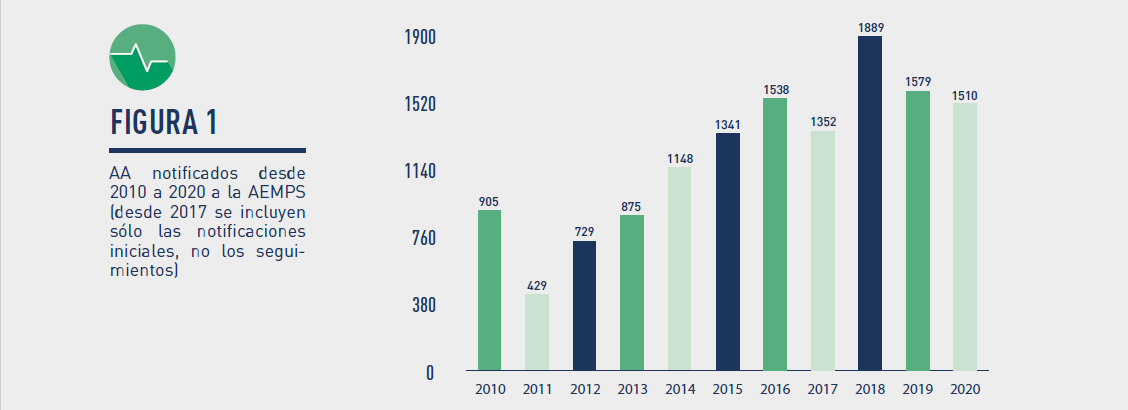
Gráfico 1 – AA notificados desde 2010 a 2020 a la AEMPS (desde 2017 se incluyen sólo las notificaciones iniciales, no los seguimientos)
En cuanto a la estratificación de estos acontecimientos adversos en el año 2020:
– Las especies de destino en que se presentaron las AA fueron las siguientes: perro, gato, oveja, cerdo, vaca, conejo, cabra, gallina, caballo, hurón, lubina, abeja y rata.
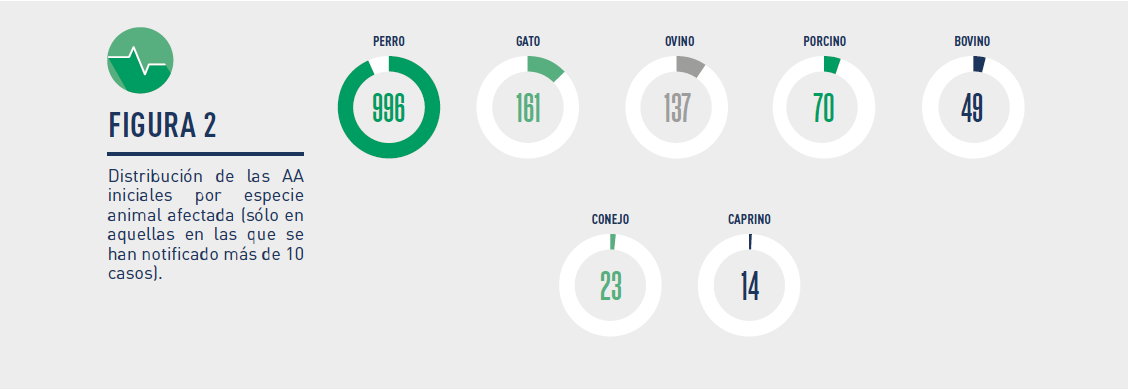
Gráfico 2 – Distribución de las AA iniciales por especie animal afectada (sólo en aquellas en las que se han notificado más de 10 casos).
– 20 casos afectaron a personas.
– Medicamentos veterinarios implicados: Los grupos en los que más frecuentemente se ha notificado corresponden a: vacunas, ectoparasiticidas, endocticidas, antimicrobianos, hormonales, antiinflamatorios no esteroideos, combinación de ingredientes activos y agentes neurológicos.
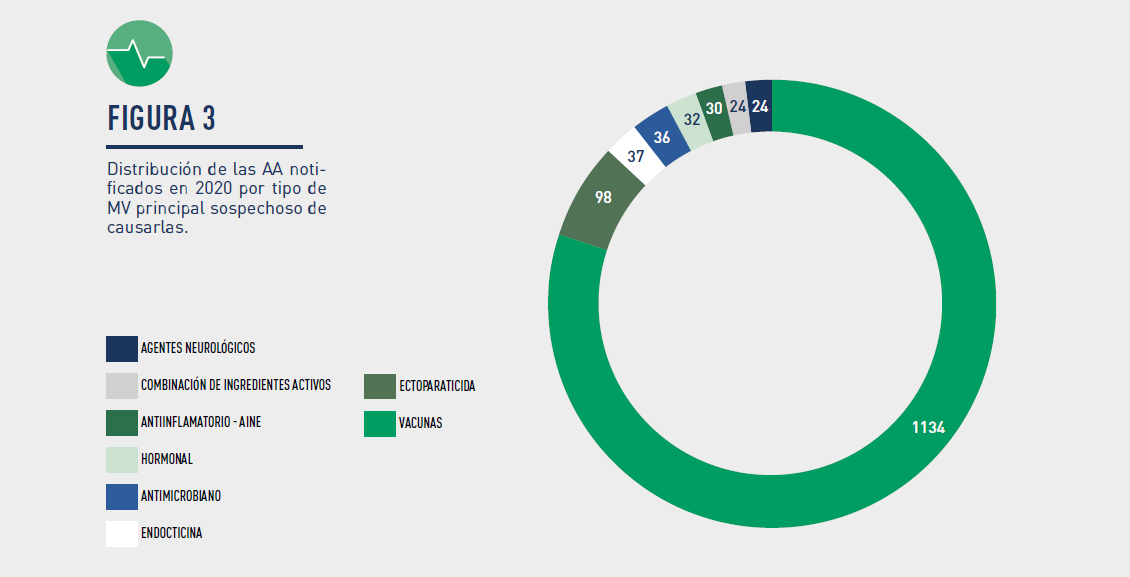
Gráfico 3 – Distribución de las AA notificados en 2020 por tipo de MV principal sospechoso de causarlas. Respecto del origen de las notificaciones iniciales, en 2020 de nuevo fue mayoritaria la realizada por los Titulares (1.377 AA, un 91,2%) frente al resto de posibles orígenes (profesionales sanitarios, ganaderos, propietarios de animales, otros usuarios, etc.), que notificaron (133 AA) el 8,8%.

Gráfico 4 – Origen de las AA notificadas a la AEMPS en 2020 Conforme se establece en la normativa europea, la AEMPS ha enviado todas las AA notificados en España a EVVET.
Informes periódicos de seguridad (IPS) y estudios posautorizacion
La legislación europea establece una serie de obligaciones en materia de FV a los Titulares y entre ellas cabe destacar la de presentar con una determinada periodicidad informes periódicos con toda la información de seguridad a nivel mundial de todos sus MV. La frecuencia de envío de estos IPS depende del conocimiento previo que se disponga del medicamento o las sustancias activas incluidas en el mismo, siendo más frecuentes en medicamentos más novedosos. En total en 2020 se recibieron 1.700.
En la evaluación de los mismos merece destacar el papel desempeñado por la AEMPS en la evaluación de IPS en el programa Worksharing aprobado por los Jefes de Agencias (HMA), que tiene por objeto armonizar las fechas de presentación de los IPS de los MV, así como distribuir la responsabilidad de su evaluación entre las agencias reguladoras de todos los Estados miembros. De esta forma, para cada una de las sustancias incluidas en el programa, se elige un país como responsable (P-RMS), que será el encargado de elaborar los informes de evaluación y consensuar las decisiones con el resto de agencias (P-CMS). Hay que saber que, una vez adoptado el informe final no acaba el trabajo de las agencias, pues en ese preciso momento se inicia la “fase nacional” en la que cada agencia decide si, a la luz del informe final y de la información crítica de seguridad expresada por el Titular (la conocida como Core Safety Data Sheet), se debe modificar la autorización de comercialización para introducir cambios en la Ficha Técnica, prospecto y etiquetado.
En 2020 se recibieron en el marco del Worksharing un total de 294 IPS, habiendo actuado España como P-RMS para 9 moléculas (cefalonio, ácido salicílico, alfaprostol, lincomicina, ramipril, cabergolina, luprostiol, ketamina, eritromicina).
Tras su evaluación y, en su caso, previo dictamen del Comité de Seguridad de Medicamentos Veterinarios (CSMV), en 37 de los IPS se concluyó que era necesario proceder a la modificación de las Fichas Técnicas.
Procedimientos centralizados, descentralizados y de reconocimeinto mutuo
En el año 2020 se elaboraron los siguientes informes actuando como Estado Miembro de Referencia o país Ponente:
- IPS: ascendieron a 48 de Reconocimiento Mutuo, 129 a Descentralizado y 18 a Centralizado.
En relación con el procedimiento de vigilancia y detección de señales de MV Centralizados en EVVET, se han realizado 18 análisis, correspondientes a las revisiones para la detección de señales de los medicamentos de los que España es ponente: Prac-tic, Spironolactone CEVA, Kexxtone, Meloxidolor, UpCard, Letifend (2 análisis en el año), Sedadex, Eravac (2 análisis en el año), Cepedex, Halagon, Clevor (2 análisis en el año),Forceris (2 análisis en el año)Isemid y Syvazul BTV.
Comité de seguridad de medicamentos veterinaniors (CSMV)
El CSMV es el órgano colegiado de la AEMPS creado para el asesoramiento técnico y científico en todo lo relativo a farmacovigilancia de los MV.
En 2020 se celebraron 3 reuniones en las que se trató la modificación de la autorización de comercialización de 37 medicamentos veterinarios. Como en el caso de los demás comités de la AEMPS se publicaron en la Web las correspondientes notas informativas de las reuniones celebradas.
Los dictámenes del CSMV y los cambios acordados en procedimientos de Reconocimiento Mutuo, Descentralizado y de Renovaciones de autorizaciones de comercialización que fueron sometidos a evaluación del CSMV, fueron los siguientes (hay que tener en cuenta que algunos de los dictámenes iniciales acordados pueden sufrir alguna modificación durante el procedimiento administrativo de implementación, ya que los titulares disponen de un plazo para realizar las alegaciones que estimen conveniente y, del estudio de estas alegaciones, pueden derivarse cambios en las modificaciones inicialmente acordadas por el CSMV, que son las que finalmente se introducen en la Ficha Técnica, Prospecto y, en su caso, en el Etiquetado):
| MEDICAMENTO | PROPUESTA DE MODIFICACIÓN DE LOS TEXTOS |
|---|---|
| BROADLINE SOLUCION SPOT-ON PARA GATOS (EU/2/13/157/001-004) | Incluir como reacción adversa el signo de ceguera transitoria o visión defectuosa (4.6 del SPC) |
| BUSCAPINA COMPOSITUM USO VETERINARIO (1859 ESP) | Incluir como reacciones adversas los signos de reacciones anafilácticas y shock cardiovascular (4.6 del SPC) |
| CANIGEN L4 SUSP INYECTABLE PARA PERROS (EU/2/15/183/001) | Incluir precauciones de uso cuando el producto entre en contacto con ojos (4.5 del SPC) |
| CANITROID SABOR 200, 400, 600 Y 800 MICROGRAMOS COMPRIMIDOS PARA PERROS (2473 ESP, 2474 ESP, 2475 ESP Y 2476 ESP) | Incluir reacciones de sensibilidad (prurito) (4.6 del SPC) |
| CEPRAVIN VACAS SECAS (2566 ESP) | Incluir precauciones especiales para su uso correcto en animales para evitar resistencias y advertir de la posibilidad de que su uso para patógenos no sensibles pueda producir una mastitis aguda grave (potencialmente mortal) debido a la infección por otras especies de patógenos, en especial Pseudomonas aeruginosa, después del secado (4.5 SPC) |
| CESTEM SABOR COMPRIMIDOS PARA PERROS MEDIANOS Y PEQUEÑOS (2170 ESP) Y CESTEM SABOR COMPRIMIDOS PARA PERROS GRANDES (2171 ESP) | Sustituir el signo vómitos, por signos gastrointestinales (vómitos y diarrea), añadir el signo letargo posiblemente asociado(4.6 del SPC) |
| CHANAZONE 1 G POLVO ORAL PARA CABALLOS (3385 ESP) | Incluir precauciones de uso en personas que lo administran: evitar inhalación (4.5 del SPC) |
| COLIDEX C (3450 ESP) | Incluir formación de nódulos, inflamación, abscesos o granulomas en el caso de lechones (4.6 del SPC). Incluir zona dorso-craneal (área más cercana a la cabeza) (4.9 del SPC) |
| COXEVAX (EU/2/10/110/001) | Incluir signos como letargia, hipertermia, y/o anorexia en vacas (4.6 del SPC) Incluir la frecuencia de la reducción en la producción de leche en vacas y cabras(4.7 del SPC) |
| CYDECTIN TRICLAMOX 5 mg/ml+200 mg/ml SOLUCION PARA UNCION DORSAL CONTINUA PARA BOVINO (2483 ESP) | Incluir como reacciones adversas los signos las reacciones de hipersensibilidad/alérgicas e irritación de la piel en el punto de inyección (4.6 del SPC) |
| CANIGEN DHPPi/L LIOFILIZADO Y SUSPENSIÓN PARA SUSPENSIÓN INYECTABLE PARA PERROS (3426 ESP) | Incluir como reacciones adversas letargia, hipertermia, signos gastrointestinales (anorexia, vómitos, diarrea) y aportar una descripción detallada de las reacciones adversas relacionadas con hipersensibilidad y reacciones anafilácticas (4.6 del SPC) |
| EMEDOG 1 MG/ML SOLUCIÓN INYECTABLE PARA PERROS (3283 ESP) | Modificación de los textos incluyendo el signo de “ataxia” (4.6 del SPC) |
| ENURACE 50, COMPRIMIDOS DE 50 MG PARA PERROS (2074 ESP) | Incluir el signo de “vómitos” (4,6 del SPC) |
| EURICAN DAPPI-LMULTI LIOFILIZADO Y SUSPENSION PARA PREPARACION DE SUSPENSION INYECTABLE (3322 ESP), EURICAN DAP-LMULTI LIOFILIZADO Y SUSPENSION PARA PREPARACION DE SUSPENSION INYECTABLE (3323 ESP) y EURICAN LMULTI SUSPENSION INYECTABLE (3324 ESP) | Incluir como reacciones adversas las reacciones de hipersensibilidad (edema facial, choque anafiláctico, urticaria) (4.6 del SPC) |
| FILAVAC VHD K C+V (3535 ESP) | Incluir hipersensibilidad, letargo e inapetencia, Se modifican las frases relativas a aumento de la temperatura y reacción local. (4.6 del SPC), |
| FIPRONILO-(S)-METOPRENO CEVA SOLUCION SPOT-ON PARA GATOS 1 -5 kg (3302 ESP), FIPRONILO-(S)-METOPRENO CEVA SOLUCION SPOT-ON PARA PERROS 2-10 KG Y GATOS > 5 KG (3303 ESP), FIPRONILO-(S)-METOPRENO CEVA SOLUCION SPOT-ON PARA PERROS 10 – 20 KG (3304 ESP), FIPRONILO-(S)-METOPRENO CEVA SOLUCION SPOT-ON PARA PERROS 20 – 40 KG ( 3305 ESP) y FIPRONILO-(S)-METOPRENO CEVA SOLUCION SPOT-ON PARA PERROS 40 – 60 KG ( 3306 ESP). | Incluir como reacciones adversas los signos de hipersalivación transitoria, vómitos, alopecia y prurito en el punto de aplicación (4.6 del SPC) |
| IMOCOLIBOV (3153 ESP) | Incluir el signo hipertermia y actualizar el orden del texto (4.6 del SPC) |
| METACAM 0,5 MG/ML SUSPENSIÓN ORAL GATOS Y COBAYAS (EU/2/97/004/026, 033-034, 049), METACAM 0,5 MG/ML SUSPENSIÓN ORAL PERROS (EU/2/97/004/012-013), METACAM 1.5 MG/ML SUSPENSIÓN ORAL PARA PERROS (EU/2/97/004/003-005, 029), METACAM 15 MG/ML SUSPENSIÓN ORAL PARA ÉQUIDOS (EU/2/97/004/ 009, 030), METACAM 15 MG/ML SUSPENSIÓN ORAL PARA CERDOS (EU/2/97/004/ 041-042), METACAM 1 MG COMPRIMIDOS MASTICABLES PARA PERROS (EU/2/97/004/043-045), METACAM 2.5 MG COMPRIMIDOS MASTICABLES PARA PERROS (EU/2/97/004/046-048), METACAM 2 MG/ML SOLUCIÓN INYECTABLE PARA GATOS (EU/2/97/004/039-040), METACAM 5 MG/ML SOLUCIÓN INYECTABLE PARA PERROS Y GATOS (EU/2/97/004/006, 011), METACAM 5 MG/ML SOLUCIÓN INYECTABLE (EU/2/97/004/001, 010, 035-038), METACAM 20 MG/ML SOLUCIÓN INYECTABLE PARA BÓVIDOS, CERDOS Y CABALLOS (EU/2/97/004/007-008, 014-015, 027-028, 031-032), METACAM 40 MG/ML SOLUCIÓN INYECTABLE PARA BOVINO Y CABALLOS (EU/2/97/004/050-053), NOVEM 5 MG/ML SOLUCIÓN INYECTABLE PARA BOVINO Y CERDOS (EU/2/04/042/001-002) y NOVEM 20 MG/ML SOLUCIÓN INYECTABLE PARA BOVINO Y CERDOS (EU/2/04/042/003-006) | Incluir precauciones de uso cuando el producto entre en contacto con ojos (4.5 del SPC) |
| METROBACTIN 250 Y 500 MG COMPRIMIDOS(3393 y 3395 ESP) | Incluir precauciones de uso en personas que lo administración: perjudicial para el feto (4.5 del SPC). Eliminar en precauciones de uso en animales la frase: “Especialmente después del tratamiento prolongado con metronidazol, pueden aparecer signos neurológicos” (4.5 del SPC) |
| MICOTIL 300 (313 ESP) | Incluir como reacciones adversas los signos de hipersensibilidad (incluida anafilaxia, que puede ser mortal) y muerte (4.6 del SPC) |
| MONZAL 100 mg/ml (656 ESP) | Incluir precauciones de uso cuando el producto entre en contacto con ojos y piel, manos e inyección accidental (4.5 del SPC) |
| OSURNIA (EU/2/14/170/001) | Incluir como precauciones especiales para su uso en animales información sobre la falta de evaluación de la seguridad y la eficacia del medicamento en gatos, incluyendo la notificación de signos neurológicos (incluido el síndrome de Horner con protrusión de la membrana nictitante, miosis, anisocoria y trastornos del oído interno con ataxia e inclinación de la cabeza) y signos sistémicos (anorexia y letargia) (4.5 SPC) |
| PROPOFOL LIPURO 10 mg/ml EMULSIÓN INYECTABLE (1578 ESP) | Incluir como reacción adversa el signo de diarrea (4.6 del SPC) |
| SOLIPHEN 60 mg COMPRIMIDOS PARA PERROS (3244 ESP) | Incluir información sobre diarreas y emesis (4.6 del SPC) |
| SUPRELORIN 4,7 MG IMPLANTE PARA PERROS (EU/2/07/072/001-002) y SUPRELORIN 9,4 MG IMPLANTE PARA PERROS Y HURONES (EU/2/07/072/003-004) | Incluir como reacciones adversas los signos de aumento de peso y la posibilidad de aparición transitoria de convulsiones debido a que la testosterona modula la susceptibilidad a las convulsiones. (4.6 del SPC) |
| TETROXYVET 200MG/ML SOLUCION INYECTABLE (3380 ESP) | Incluir precauciones de uso en personas que lo administración: perjudicial para el feto (4.5. SPC). Añadir que es toxico reproductivo para animales de laboratorio y que se puede usar en lactación, pero se elimina el termino seguro en lactación (4.7 del SPC) |
| ADVOCATE 40mg + 4mg SOLUCION PARA UNCION DORSAL PUNTUAL PARA PERROS PEQUEÑOS (EU/2/03/039/005-6) ADVOCATE 100mg + 25mg SOLUCION PARA UNCION DORSAL PUNTUAL PARA PERROS MEDIANOS (EU/2/03/039/007-8) ADVOCATE 250mg + 62,5mg SOLUCION PARA UNCION DORSAL PUNTUAL PARA PERROS GRANDES (EU/2/03/039/009-10) ADVOCATE 400mg + 100mg SOLUCION PARA UNCION DORSAL PUNTUAL PARA PERROS MUY GRANDES (EU/2/03/039/011-12) | En el apartado 4.6 de la Ficha técnica y en el apartado 6 del prospecto, se añade la siguiente frase: “Se han notificado reacciones locales de sensibilidad cutánea pasajera, que incluyen picor, pérdida de pelo, pelo grasiento y enrojecimiento en el lugar de aplicación en muy raras ocasiones a través de los informes espontáneos (Farmacovigilancia).)”. |
| VETEGLAN 0,075 mg/ml SOLUCION INYECTABLE PARA VACAS, CERDAS Y YEGUAS (nº reg. 1798 ESP) | En el apartado 4.6 Reacciones adversas (frecuencia y gravedad) de la ficha técnica y 6 Reacciones adversas del Prospecto, se han añadido aumento de la frecuencia respiratoria y cardíaca, signos de malestar abdominal, diarrea acuosa y depresión El apartado 4.5 Precauciones especiales de uso en animales de la Ficha Técnica y 12 Advertencias especiales del Prospecto, ha sido actualizado |
| SERESTO COLLAR 1,25 G + 0,56 G PARA GATOS (2348 ESP) } SERESTO COLLAR 1,25 G + 0,56 G PARA PERROS ≤ 8 KG (2349 ESP) } SERESTO COLLAR 1,25 G + 0,56 G PARA PERROS ≤ 8 KG Y GATOS (2350 ESP) } SERESTO COLLAR 4,50 G + 2,03 G PARA PERROS > 8 KG (2351 ESP) | En el apartado 4.5 de la Ficha Técnica y en el apartado 12 del prospecto se añade: “Imidacloprid y flumetrina se liberan de forma continuada del collar hacia la piel y pelaje mientras el collar está colocado. El medicamento veterinario puede causar reacciones de hipersensibilidad en algunas personas.” En el apartado 4.6 de la Ficha técnica y en el apartado 6 del prospecto se añade cambios en el comportamiento como «esconderse, vocalización, hiperactividad, lamido y/o aseo excesivos» y también: “En muy raras ocasiones, se notificó agresión tras la aplicación del collar», adicionalmente una advertencia sobre la colocación correcta del collar. |
| ORBESEAL (1492 ESP) | En el apartado 4.5 de la Ficha Técnica y en el apartado 12 del Prospecto se actualiza el texto En el apartado 4.6 de la Ficha Técnica y en el apartado 6 del Prospecto se actualiza el texto, añadiendo lo siguiente: “Casos de mastitis aguda se han notificado en muy raras ocasiones después del uso de este producto, principalmente debido a la mala técnica de administración y a la falta de higiene. Por favor, consulte las secciones 4.5. y 4.9 (8 y 12 en Prospecto) sobre la importancia de la técnica aséptica.” |
| PORCILIS LAWSONIA (3814 ESP) | El apartado “Interacción con otros medicamentos y otras formas de interacción” de la ficha técnica y del prospecto ha cambiado |
| NOVEM SOLUCIÓN INYECTABLE PARA BOVINO Y CERDOS 5 MG/ML Y 20 MG/ML (EU/2/04/042/001-006) | En los apartados 4.5 de la Ficha Técnica y 12 del Prospecto, Precauciones específicas que debe tomar la persona que administre el medicamento veterinario a los animales, se añade la siguiente frase: “Este medicamento veterinario puede causar irritación ocular. En caso de contacto con los ojos, enjuagar inmediatamente con abundante agua.” |
Comité técnico del sistema español de farmacovigilancia de medicamentos veterinarios (CTSEF-VET)
El CTSEF-VET es el órgano colegiado de la AEMPS que tiene por objeto unificar los criterios de funcionamiento y evaluar las Señales a MV detectadas por el Sistema Español de Farmacovigilancia de Medicamentos Veterinarios.
Es importante destacar que cuenta con la participación de todas las Comunidades Autónomas y de las Ciudades Autónomas de Ceuta y Melilla.
Se celebró una reunión en 2020, siendo lo fundamental a destacar: la revisión de las actividades de los distintos agentes en base a las obligaciones recogidas en el documento de Buenas Prácticas de Farmacovigilancia Veterinaria del Sistema Español de Farmacovigilancia Veterinaria, y se discutieron los informes preparados por el DMV relativos a los procedimientos de Detección de Señales realizados a nivel europeo y nacional.
Asimismo, se revisaron las estadísticas nacionales de Farmacovigilancia veterinaria, se analizaron las novedades referentes a Farmacovigilancia veterinaria que introduce el Reglamento (UE) 2019/06 del Parlamento Europeo y del Consejo, las alertas de Farmacovigilancia y la situación específica de algunos medicamentos a nivel nacional
Alertas e informaciones de seguridad no urgente (NUIS) por razones de farmacovigilancia
En el 2020 no se decretó ninguna alerta por razones de Farmacovigilancia.
En el 2020 recibieron y gestionaron, por afectar a MV registrados en España, 5 NUIS.
Alertas por defectos de calidad
En el 2020 se decretaron seis Alertas por Defectos de Calidad:
- Alerta por defecto de calidad de medicamentos veterinarios nº VDC1/2020: Varios lotes de 3 presentaciones de CLABUVACTIN COMPRIMIDOS.
- Alerta por defecto de calidad de medicamentos veterinarios nº VDC2/2020: IVERTIN 10 MG/ML SOLUCIÓN INYECTABLE PARA BOVINO, OVINO Y PORCINO (3381 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ 3/2020: FLOXABACTIN 15 MG COMPRIMIDOS PARA GATOS Y PERROS (2211 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ 4/2020: NOROCARP 50 MG/ML SOLUCIÓN INYECTABLE PARA BOVINO (2053 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ 5/2020: OTIMECTIN 1 MG/G GEL OTICO PARA GATOS (2687 ESP)
- Alerta por defecto de calidad de medicamentos veterinarios nº VDQ 6/2020: NEOMECTIN 12 MG/G GEL ORAL PARA CABALLOS (2003 ESP)
Promoción de la farmacovigilancia veterinaria
La promoción de la FVV sigue siendo un punto estratégico para la AEMPS además de una obligación legal contemplada en las directivas europeas y en el Real Decreto 1246/2008. Esta prioridad se fundamenta en que la UE considera prioritario incrementar los niveles de notificación, por lo que se ha incluido este objetivo en la planificación estratégica del Grupo de Jefes de Agencias de la UE (HMA) y en su Subgrupo de Estrategias de Farmacovigilancia (ESS).
En 2020 se impartieron charlas técnicas destinadas a la formación de futuros veterinarios en las Facultades de Veterinaria de: Barcelona, Murcia y Valencia (Universidad Católica de Valencia). Por motivo la pandemia no se pudo llevar a cabo en el 2020 un número similar de charlas que años previos.
Del mismo modo se participó en el Master de Farmacoepidemiología y Farmacovigilancia organizado por la Universidad de Alcalá de Henares.
Participación en reuniones internacionales
En relación con las actividades de FVV a nivel europeo en 2020, cabe destacar la participación en los siguientes Grupos y Comités: Grupo de Farmacovigilancia Veterinaria del CVMP, Subgrupo de Terminología VEDDRA, Grupo Regulators sobre el programa de Worksharing de IPS y Subgrupo ESS de HMA.
Así como la participación activa de tres expertos seleccionados en los actos de desarrollo del Reglamento (UE) 2019/6 del Parlamento Europeo y del Consejo de 11 de diciembre de 2018 sobre medicamentos veterinarios y por el que se deroga la Directiva 2001/82/CE.

