Última actualización: 13/7/2018
NOTA: este documento de preguntas y respuestas debe considerarse en el contexto regulatorio del momento en el cual se publica, sin perjuicio de la legislación vigente ni de los avances en los requerimientos regulatorios que puedan tener lugar con posterioridad. En este sentido, este documento se emite sin perjuicio del obligado cumplimiento del REGLAMENTO DELEGADO (UE) 2016/161 DE LA COMISIÓN de 2 de octubre de 2015 que completa la Directiva 2001/83/CE del Parlamento Europeo y del Consejo estableciendo disposiciones detalladas relativas a los dispositivos de seguridad que figuran en el envase de los medicamentos de uso humano, de la última versión del Documento de Preguntas y Respuestas (Q&A) en relación con los Dispositivos de Seguridad de Medicamentos de uso humano publicado por la Comisión Europea y sus modificaciones futuras y de la Nota Informativa sobre Implementación de los Dispositivos de Seguridad en las Autorizaciones de Comercialización de los medicamentos de uso humano del 12 de Julio de 2017, en adelante “NI DS”, publicada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
ÍNDICE DE CONTENIDOS
- INTRODUCCIÓN
-
ASPECTOS RELACIONADOS CON EL ETIQUETADO Y PROCEDIMIENTOS DE REGISTRO
- ¿CÓMO EXPRESAR LA INFORMACIÓN DEL IDENTIFICADOR ÚNICO (IU)?
- ¿CÓMO EXPRESAR EL LOTE Y CADUCIDAD EN EL EMBALAJE EXTERIOR?
- MAQUETAS DE LOS FORMATOS NO COMERCIALIZADOS
- ¿CÓMO SE INCORPORARÁ A LOS DATOS DEL REGISTRO EL GTIN DEL FORMATO CUANDO EL TAC OPTE POR ESTA ALTERNATIVA PARA IDENTIFICAR EL PC?
- OFICIADO DE NOTIFICACIONES CONFORME AL ARTÍCULO 61(3)
- EN RELACIÓN A LAS TASAS CUANDO SE TRATA DE UN MEDICAMENTO AUTORIZADO POR RM/DC
- NÚMERO DE DÍGITOS DEL CN
- NECESIDAD DE INCLUIR EL BRAILLE EN 2 Ó 3 LÍNEAS Y ABREVIATURAS
- EN EL CASO DE MEDICAMENTOS QUE NO ESTUVIERAN AFECTADOS POR LA OBLIGACIÓN DE INCORPORAR DISPOSITIVOS DE SEGURIDAD, ¿DEBE ACTUALIZARSE LA PLANTILLA QRD INCLUYENDO LAS SECCIONES 17 Y 18 ANTES DEL 9 DE FEBRERO DE 2019?
- EN EL CASO DE MEDICAMENTOS QUE NO ESTUVIERAN AFECTADOS POR LA OBLIGACIÓN DE INCORPORAR DISPOSITIVOS DE SEGURIDAD PERO INCORPOREN UN CÓDIGO DE BARRAS BIDIMENSIONAL PARA OTROS OBJETIVOS DIFERENTES (P. EJ. PRECIO, REEMBOLSO, LOTE, CADUCIDAD…), ¿CÓMO DEBE NOTIFICARLO A LA AEMPS?
- OTRAS CONSIDERACIONES A TENER EN CUENTA
- DISPOSITIVOS CONTRA MANIPULACIONES (DCM)
- MEDICAMENTOS EXTRANJEROS PARA ATENDER NECESIDADES ESPECIALES
-
FABRICACIÓN Y CONTROL
- LA INSTALACIÓN DE EQUIPOS PARA LA SERIALIZACIÓN DE LOS ENVASES, ¿REQUIERE ALGÚN TIPO DE COMUNICACIÓN A LA AEMPS?
- ETIQUETAS
- MUESTRAS GRATUITAS
- ¿CUÁLES SON LAS CONDICIONES QUE SE DEBEN CUMPLIR EN CASO DE QUE UN LABORATORIO ENCARGUE LA IMPRESIÓN DEL IU A UN TERCERO CONTRATADO?
- EN EL CASO DE UTILIZAR ENVASES PRE-SERIALIZADOS, ¿ES POSIBLE CARGAR EN EL REPOSITORIO TODOS LOS IU RECIBIDOS DEL PROVEEDOR QUE HA PRE-SERIALIZADO LOS ENVASES?
- DISPOSITIVO CONTRA MANIPULACIONES (DCM)
1. INTRODUCCIÓN (Índice)
El presente documento está dirigido a la Industria Farmacéutica y pretende responder a las preguntas frecuentes en relación con la aplicación de la NI DS y recoge la respuesta que desde la AEMPS se da a las preguntas surgidas desde la publicación de la mencionada NI. La información contenida en este documento no es exhaustiva y se considera responsabilidad del Titular de la Autorización de Comercialización (TAC) asegurar el cumplimiento de los requerimientos establecidos en la normativa más arriba referenciada. La versión que aquí se presenta es el resultado del trabajo de técnicos del Departamento de Medicamentos de Uso Humano y Departamento de Inspección y Control de Medicamentos de la AEMPS, y se ha consultado con profesionales que trabajan en compañías farmacéuticas, por lo que será una herramienta útil para el sector. No obstante, se trata de un documento dinámico, que podrá estar sujeto a cambios en función de las necesidades, nuevas preguntas que vayan surgiendo, así como a la publicación de nuevas versiones del Documento de Preguntas y Respuestas de la Comisión Europea. Por tanto, su carácter es informativo y podrá ser modificado. Cualquier consulta, aclaración o propuesta de mejora podrá dirigirse a la dirección: dgestion@aemps.es2. ASPECTOS RELACIONADOS CON EL ETIQUETADO Y PROCEDIMIENTOS DE REGISTRO (Índice)
2.1 ¿CÓMO EXPRESAR LA INFORMACIÓN DEL IDENTIFICADOR ÚNICO (IU)? (Índice)
Se muestran ejemplos consultados (el Datamatrix y los números empleados son ficticios): PC: código del producto SN: número de serie NN: número nacional de reembolso Lote/Lot: Lote CAD/EXP: Caducidad| Identificador único: Información en caracteres visuales | Caso | Permiso | ||
|---|---|---|---|---|
 |
PC SN Lote CAD | 08470008722513 6874352687 L201JX32 Ene 2021 | CASO 1: La información adyacente al Datamatrix incluye PC, SN, lote y caducidad. | PERMITIDO |
 |
PC SN | 08470008722513 6874352687 | CASO 2: La información sobre lote y caducidad incluye en otra zona del embalaje exterior. | PERMITIDO |
 |
PC SN Lote CAD | 08470008722513 6874352687 L201JX32 Ene 2021 | CASO 3: PC está pre-impreso. La información adyacente al Datamatrix incluye PC, SN, lote y caducidad. | PERMITIDO |
 |
PC SN | 08470008722513 6874352687 | CASO 4: PC está pre-impreso. La información sobre lote y caducidad se incluye en otra zona del embalaje exterior. | PERMITIDO |
 |
PC SN Lote CAD | 08470008722513 6874352687 L201JX32 Ene 2021 | CASO 5: La información está toda pre-impresa en vez de ser impresa en línea. | PERMITIDO |
 |
PC SN | 08470008722513 6874352687 | CASO 6: La información de PC y SN está pre-impresa. La información sobre lote y caducidad se incluye en otra zona del embalaje exterior. | PERMITIDO |
 |
PC SN Lote CAD | 08470008722513 6874352687 L201JX32 Ene 2021 | CASO 7: La información sobre PC y SN está pre-impresa. Lote y caducidad se imprimen en línea en la zona adyacente. | PERMITIDO |
 |
PC SN | (01) 8470008722513 (21) 6874352687 | CASO 8: Se incluyen los prefijos de los elementos del IU en caracteres visuales. | PERMITIDO1 |
 |
PC SN Lote CAD | (01) 08470008722513 (21) 6874352687 (10) L201JX32 (17) Ene 2021 | CASO 9: Se incluyen los prefijos (01), (21), de los elementos del IU así como los prefijos (10), (17) para Lote y CAD en caracteres visuales. | PERMITIDO1 |
 |
PC SN Lote CAD | (01) 08473543123678 (21) 687435268 (10) L201JX32 Ene 2021 | CASO 10: Se suprime el (17) en caducidad para evitar toda confusión con el año. | PERMITIDO1 |
 |
PC SN Lote CAD | (01NTIN) 08470008722513 (21) 6874352687 (10) L201JX32 (17) Ene 2021 | CASO 11: Se incluyen las siglas NTIN o GTIN y los prefijos (01), (21), (10), (17) de los elementos del IU en forma legible y otra información adicional para el PC. | NO PERMITIDO1 |
 |
PC SN NN Lote CAD | 08470008722513 6874352687 872251.3 L201JX32 Ene 2021 | CASO 12: Se incluye el NN como información adicional, con un PC NTIN, duplicando el Número Nacional de reembolso (que debe figurar en el ángulo superior derecho de la cara principal o de la blue box). | PERMITIDO |
 |
PC SN NN Lote CAD | 08473543123678 6874352687 872251.3 L201JX32 Ene 2021 | CASO 13: Se incluye el NN como información adicional, con un PC GTIN, duplicando el Número Nacional de reembolso (que debe figurar en el ángulo superior derecho de la cara principal o de la blue box). | PERMITIDO |
 |
PC: SN: Lote: CAD: | 08473543123678 687435268 L201JX32 Ene 2021 | CASO 14: Los prefijos PC y SN se indican como en la plantilla del QRD con dos puntos (:). También se permiten (:) en Lote y Caducidad. | PERMITIDO |
 |
PC Lote CAD SN | 08473543123678 L201JX32 Ene 2021 687435268 | CASO 15: La información se mantiene en otro orden. | PERMITIDO2 |
 |
PC/SN/LOT/EXP: 08470006723459 98876582837645683 Bhj7869d 02-2020 | CASO 16: Disposición en línea de los títulos de los elementos del IU: (PC/SN/LOT/EXP) se indican a modo de título pre-impreso. | PERMITIDO3 | |
 |
PC 08470006723459 LOT/EXP/SN Bhj7869d 02-2020 98876582837645683 | CASO 17: Disposición en línea de los títulos de los elementos del IU (LOT/EXP/SN) | PERMITIDO3 | |
 |
PC SN Lote CAD | — N.A. L201JX32 Ene 2021 | CASO 18: Durante el período de transición (hasta el 09 febrero 2019), en las líneas del identificador único que corresponden a PC y/o SN figura impreso “NA” o “-“ | NO PERMITIDO |
 |
PC SN Lote CAD | L201JX32 Ene 2021 | CASO 19: Durante el período de transición (hasta el 09 febrero 2019), las líneas del identificador único que corresponden a PC y/o SN están vacías. | PERMITIDO |
 |
CAD/Lote PC SN | 10.2020 3X6T 08470006540206 3BSBGH62B2 | CASO 20: poner pre-impreso el texto “CAD/Lote” y debajo el resto de la información, identificando sólo las líneas de PC y SN. | PERMITIDO |
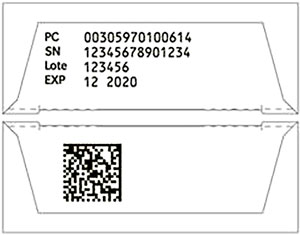 |
CASO 21: Cuando las dimensiones del envase no permitan que aparezcan en la misma cara Datamatrix e información en caracteres visuales, ¿está permitido que aparezcan en dos caras diferentes? | PERMITIDO4 | ||
 |
GTIN SN Lote CAD | 08473543123678 687435268 L201JX32 Ene 2021 | CASO 22: poner GTIN en vez de PC. | NO PERMITIDO |
 |
PC (GTIN) SN | CASO 23: Multilingüe. | CONTACTAR CON AEMPS PARA RESOLVER CASO POR CASO | |
| PC SN Lote CAD | L201JX32 Ene 2021 | CASO 24: Durante el período de transición (hasta el 09 febrero 2019), se permite sin Datamatrix y PC y SN pre-impreso vacío. Lote y Caducidad ya impresos previamente. | PERMITIDO | |
| PC SN Lote CAD | 08470008722513 L201JX32 Ene 2021 | CASO 25: PC está pre-impreso, durante el período de transición (hasta el 09 febrero 2019), en las líneas del identificador único que corresponden a SN está vacío. | PERMITIDO | |
 |
PC SN Lot CAD | 08473543123678 687435268 L201JX32 Ene 2021 | CASO 26: posición del Datamatrix a la derecha. | PERMITIDO |

