El 31 de enero de 2025 finaliza el periodo de transición al Reglamento.
Todos los ensayos cuya continuación esté prevista después del 30 de enero de 2025 deberán transicionar al Reglamento (UE) 536/2014 de ensayos clínicos, para lo que se deberá presentar una solicitud de transición a través del Clinical Trials Information System (CTIS) con la suficiente antelación. Consulta toda la información en el apartado sobre el periodo de transición.
Desde el 31 de enero de 2023 todas las nuevas solicitudes de ensayo clínico deben ir a través del sistema europeo CTIS.
Todas las solicitudes de ensayo clínico que se tramiten a través de CTIS tendrán una decisión que el promotor recibirá en el propio sistema, que tendrá plena validez de acuerdo con el Reglamento 536/2014, sin necesidad de resoluciones adicionales a nivel nacional. En cualquier caso, se podrá interponer potestativamente Recurso de Reposición ante el/la Director/a de la Agencia Española de Medicamentos y Productos Sanitarios en el plazo de un mes, conforme a lo dispuesto en los artículos 123 y 124 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas, o interponerse Recurso Contencioso-Administrativo ante el Juzgado Central de lo Contencioso-Administrativo de Madrid, en el plazo de dos meses a contar desde el día siguiente a la recepción de la notificación de la decisión, conforme a lo dispuesto en la Ley Reguladora de la Jurisdicción Contencioso-Administrativa de 13 de julio de 1998, y sin perjuicio de cualquier otro recurso que pudiera interponerse.
El 31 de julio, la Comisión Europea publicó en el Diario Oficial de la Unión Europea la Decisión 2021/1240, de 13 de julio de 2021, sobre la plena funcionalidad del portal del Sistema de Información de Ensayos Clínicos (CTIS, por sus siglas en inglés) y la base de datos de ensayos clínicos de la UE.
Por lo tanto, la aplicación plena del Reglamento de Ensayos Clínicos (UE) nº 536/2014 (en adelante, Reglamento EC) en todos los países de la UE y del Espacio Económico Europeo (EEE) –Islandia, Liechtenstein y Noruega– tuvo lugar el 31 de enero de 2022.
Los siguientes apartados tienen como objetivo proporcionar a las partes interesadas más información sobre la aplicación del Reglamento EC.
Desde el 31 de enero de 2023 CTIS es el punto de entrada único para enviar información de ensayos clínicos, en la UE y en el EEE.
El portal CTIS es un espacio de trabajo para los promotores de ensayos clínicos y otro para las autoridades competentes, y una web pública de consulta de ensayos clinicos
Los Estados miembros de la UE y los países del EEE evaluarán y supervisarán los ensayos clínicos en CTIS, mientras que la Agencia Europea de Medicamentos (EMA) establecerá y realizará las labores de mantenimiento del portal CTIS. Por su parte, la Comisión Europea asegurará la correcta interpretación e implementación del Reglamento EC.
El objetivo del reglamento es crear un entorno favorable para la realización de ensayos clínicos en Europa y, al mismo tiempo, garantizar que se mantengan altos estándares de calidad de los mismos, que preserven la seguridad de los participantes.
La aplicación del Reglamento EC conllevará lo siguiente:
- Normas idénticas para la realización de ensayos clínicos en el EEE.
- Misma documentación científica del ensayo (parte I) para todos los Estados miembros de la UE y los países del EEE implicados, complementada por documentación referente a los aspectos prácticos de su realización (parte II) para cada uno de los estados.
- Aumento de la eficiencia en el proceso de aprobación de ensayos clínicos, preservando la necesidad de que el ensayo se autorice en cada país.
- Una única presentación de la solicitud del ensayo clínico a través de CTIS dirigida a todos los estados implicados.
- Un procedimiento coordinado de evaluación de la parte I por los Estados miembros involucrados, y dirigido por uno de ellos (Estado miembro notificante de referencia), mediante el principio de reconocimiento mutuo de esta evaluación.
- Principio de decisión única (en cada estado, la opinión integrará la opinión de la autoridad competente y del comité ético, según corresponda).
- Plazos de evaluación claros y principio de aprobación (para el estado) o desistimiento (para el promotor) tácitos, en caso de no respuesta en plazo.
- Aumento de la transparencia, ya que estarán a disposición del público documentos del ensayo, detalles de su evaluación y un resumen de sus resultados en formato lego.
El CTIS apoyará los procesos de trabajo de los Estados miembros de la UE, los países del EEE y los promotores, durante todo el ciclo de vida de un ensayo clínico. Asimismo, proporcionará supervisión reglamentaria de los ensayos y herramientas para su seguimiento:
- Herramientas para el envío por parte del promotor de solicitudes iniciales de autorización de un ensayo clínico; de modificaciones relevantes para un ensayo clínico autorizado, o solicitudes de adición de uno o más Estados miembros.
- Evaluación
- Monitorización y vigilancia de la seguridad en los ensayos clínicos una vez autorizados
- Notificaciones
- Medidas correctivas
- Seguimiento de la seguridad
- Actualización de datos necesarios para el correcto seguimiento de los ensayos clínicos
- Actualización de los ensayos clínicos (notificación de modificaciones no relevantes)
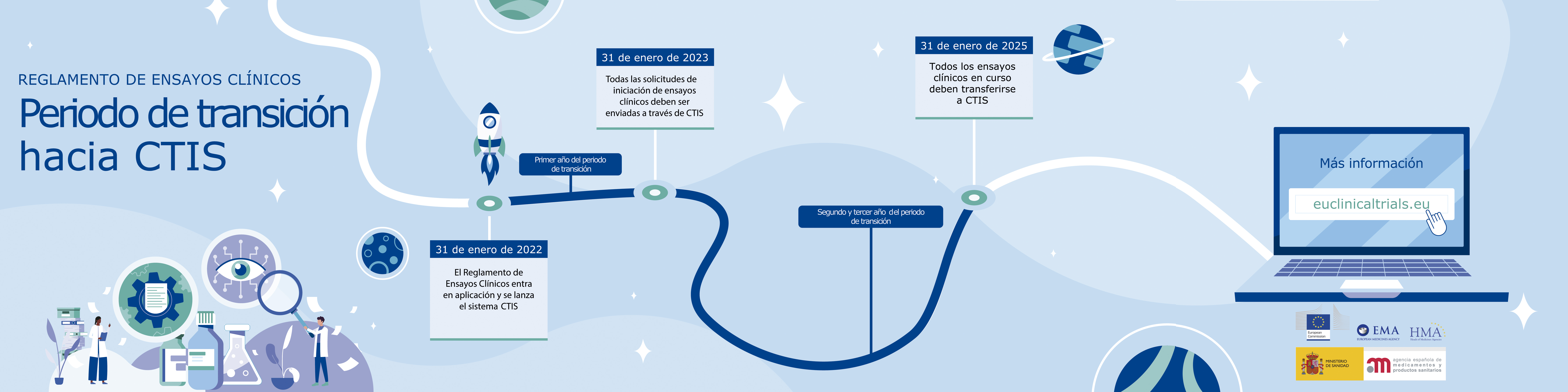
Dentro del periodo, cabe destacar las siguientes fechas:
- Del 31 de enero de 2022 hasta el 31 de enero de 2023: todas las solicitudes iniciales de ensayos clínicos podrán presentarse de conformidad con el Reglamento EC o según las legislaciones nacionales vigentes que transponen la Directiva 2001/20/CE (en el caso de España, el Real Decreto 1090/2015, incluidas las disposiciones transitorias segunda y tercera).
- A partir del 31 de enero de 2023: todas las solicitudes iniciales de ensayos clínicos deben presentarse de conformidad con el Reglamento EC y a través del portal CTIS.
- Del 31 de enero de 2022 hasta el 31 de noviembre de 2024: los ensayos clínicos en curso, previamente autorizados, pueden permanecer bajo la legislación sobre la que se autorizaron o pueden acogerse a las disposiciones del Reglamento EC, enviándose la solicitud de transición vía CTIS. Esto quiere decir que los promotores de ensayos clínicos en marcha pueden, en cualquier momento, acogerse a estas disposiciones a través de CTIS. Asimismo, los promotores deberán tener en cuenta que este periodo de adaptación puede oscilar de los 60 a los 106 días, por tanto, deben hacer la solicitud de transición con tiempo suficiente por si fuera necesario realizar aclaraciones.
- El 31 de enero de 2025 se requerirá que todos los ensayos clínicos en curso hayan realizado la transición al Reglamento EC y su autorización conste en CTIS.
Para completar la transición de una manera adecuada consultar la Guía para la transición de ensayos clínicos de la Directiva al Reglamento, publicada en EudraLex – Volume 10 – Clinical trials guidelines, así como los documentos de Buenas prácticas para la transición publicados en la sección CTCG Key documents list de la página web del HMA.
LA EMA, en colaboración con los Estados miembro, ha desarrollado un programa de formación modular y en línea, que cubren el ciclo de vida completo de la presentación, autorización y supervisión de ensayos clínicos.
Estos progrmas están diseñados para ayudar a los patrocinadores de ensayos clínicos, las autoridades nacionales competentes, los comités de ética, la Comisión Europea y el personal de la EMA a prepararse para usar el Sistema de Información de Ensayos Clínicos (CTIS).
El Reglamento (UE) Nº 536/2014 sobre los ensayos clínicos con medicamentos de uso humano establece que la información contenida en el Clinical Trials Information System (CTIS) debe ser pública exceptuando los datos personales, la información comercial confidencial y la comunicación entre Estados Miembros para la evaluación y supervisión de los ensayos.
Con la puesta en marcha de CTIS en enero de 2022 se definieron unas normas de transparencia según las cuales se publicaría toda la información proporcionada durante el ciclo de vida del ensayo salvo los documentos relativos a la calidad, datos financieros y cierta información sobre su supervisión.
Esto requería que los usuarios tuvieran que proteger los datos personales y la información comercial confidencial subiendo al sistema una versión completa o not for publication de los documentos y otra for publication ocultando la información sensible. Además, se instauró un mecanismo para retrasar su publicación durante un tiempo mayor o menor en función de la categoría del ensayo (mecanismo de deferral).
Todo ello resultó entrañar una gran complejidad para los usuarios CTIS, por lo que se acordaron unas nuevas normas de transparencia simplificadas que facilitaran el manejo del sistema y aumentaran la eficiencia.
Las nuevas normas de transparencia de CTIS, publicadas el 5 de octubre de 2023, serán aplicables a partir del 18 de junio de 2024, con la actualización del portal público de CTIS.
Los cambios principales que implicarán las nuevas normas están relacionados con la reducción del número de documentos y de la información de los campos estructurados de CTIS que se hacen públicos y la eliminación del mecanismo de deferral.
Toda la información sobre las normas de transparencia se encuentra publicada en la sección Transparency del apartado Guidance and Q&As de la página web europea de ensayos clínicos.
La AEMPS actualizará el contenido de esta página en función de la información disponible.
Para cualquier duda al respecto, pueden dirigirse al buzón del Área de Ensayos Clínicos de la AEMPS (aecaem@aemps.es).
Si por cualquier motivo la duda no se pudiese resolver desde ese buzón, el personal responsable de su revisión la canalizará al buzón adecuado, por lo que no es necesario enviar la misma consulta varias veces.

