Con el objetivo de optimizar la gestión y mejorar la predictibilidad del proceso, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha establecido un calendario armonizado para las solicitudes de autorización de comercialización de medicamentos de uso humano presentadas mediante procedimiento nacional.
Este calendario entrará en vigor el 1 de noviembre de 2025 y permitirá a las compañías conocer de antemano los plazos desde la presentación de una solicitud hasta la resolución definitiva, favoreciendo una tramitación más eficiente y transparente.
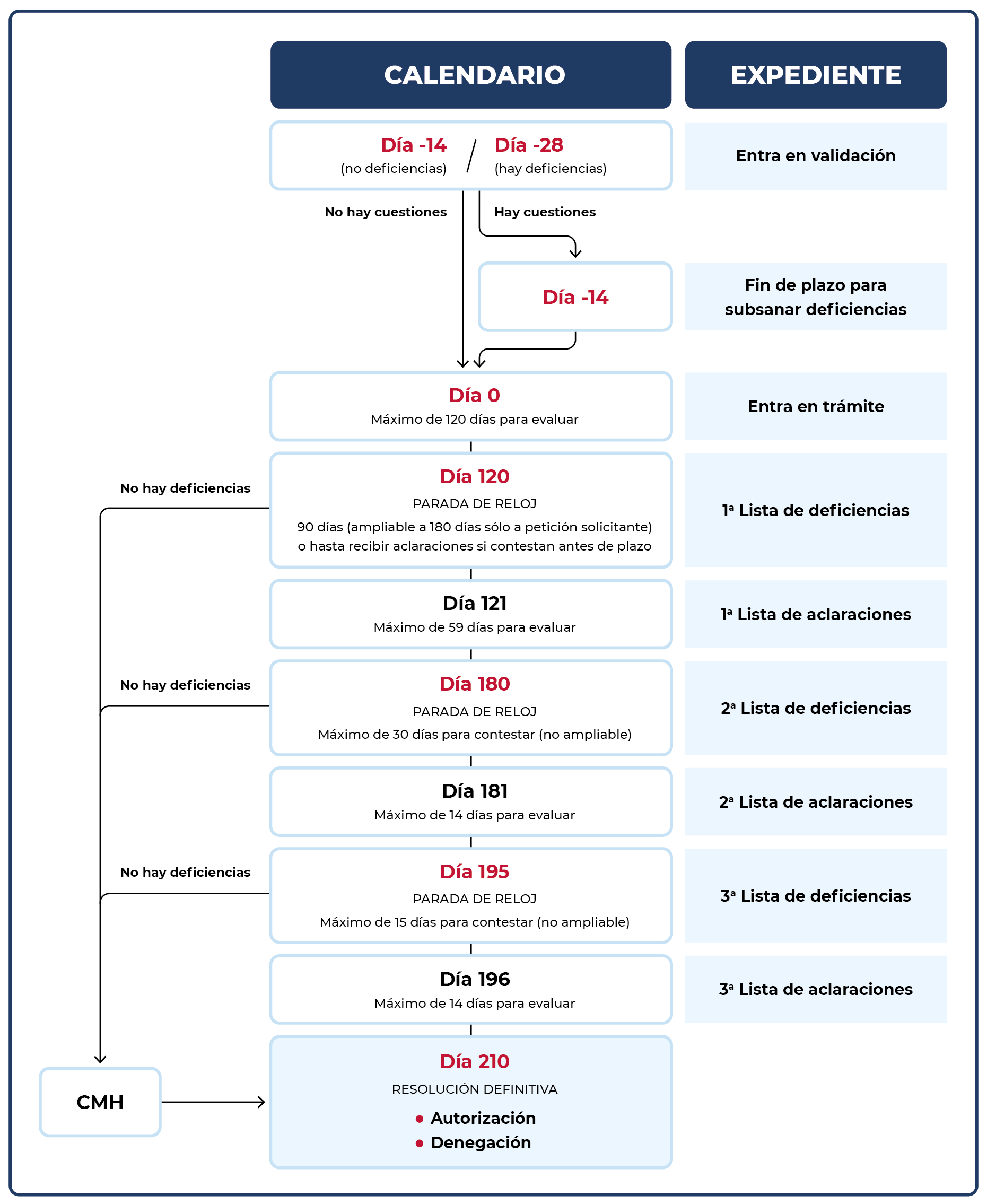
Características principales del calendario
- El procedimiento establece un plazo máximo de 210 días naturales desde la validación de la solicitud hasta la emisión de la resolución definitiva.
- Durante el proceso de evaluación pueden producirse hasta tres rondas de listas de deficiencias y/o aclaraciones.
- Se establece un sistema de paradas de reloj para la presentación de respuestas por el solicitante, con plazos bien definidos y ampliable en la primera de ellas.
- Una vez finalizada la evaluación, que no excederá el plazo máximo, la AEMPS solicitará al Comité de Medicamentos de Uso Humano (CMH) un único dictamen y procederá a emitir la resolución definitiva correspondiente (autorización o denegación).
El siguiente esquema muestra de forma visual las distintas fases del calendario y los plazos asociados:
Presentación de aclaraciones y prórrogas
- Las respuestas del solicitante comunicadas durante la fase de validación y de evaluación deberán presentarse obligatoriamente por secuencia mediante un documento técnico común en formato electrónico (eCTD, por sus siglas en inglés).
- En el envío (envelope) del eCTD deberá indicarse lo siguiente:
- Submission Type (Tipo de solicitud): Marketing authorisation (autorización de comercialización).
- Submission Unit (Unidad de solicitud): For rectifying business validation issues / Response to any kind of questions (para rectificar problemas de validación o responder a cualquier tipo de preguntas).
- Related Sequence (Secuencia relacionada): debe vincularse con la secuencia de solicitud inicial.
- Submission Description (Descripción de la solicitud):
- Respuestas a las deficiencias de validación
- Respuestas a la división evaluadora que corresponda y número de ronda de deficiencias y/o aclaraciones (1ª, 2ª y 3ª)
- Prórroga a petición del solicitante (solo en el caso de la primera ronda)
- Sólo en la primera ronda (entre los días 120 y 121), el solicitante podrá presentar una solicitud de prórroga. En ese caso, la parada de reloj se ampliará de manera automática a 180 días y el calendario se reiniciará una vez recibidas las repuestas. Esta solicitud también deberá remitirse por secuencia.
- No se aceptará el envío de deficiencias y/o aclaraciones ni solicitudes de prórroga por correo electrónico.
Consideraciones adicionales
- Las listas de deficiencias y/o aclaraciones serán emitidas por las divisiones encargadas de evaluar la calidad, seguridad y eficacia. La lista de deficiencias y/o aclaraciones de cada división podrá recibirse en distintos momentos dentro del plazo máximo. El plazo de respuesta será el indicado por cada División en su lista de deficiencias / aclaraciones.
- Es imprescindible presentar la evaluación del riesgo medioambiental conforme a la Guideline on the environmental risk assessment of medicinal products for human use, en vigor desde el 1 de septiembre de 2024. Según esta guía no se considera adecuado el uso de datos de consumo para el refinamiento del Fpen (factor de penetración en el mercado). Además, ciertas sustancias (como los antibacterianos) requerirán estrategias específicas de evaluación.
- En casos excepcionales (expedientes idénticos con calendarios distintos o duplicados, licencias, Archivo Maestro del Sistema de Farmacovigilancia (AMSF) en evaluación a nivel europeo, etc.), la AEMPS podrá equiparar los calendarios de evaluación con el objetivo de facilitar una evaluación armonizada y una gestión más eficaz.

