Índice
Introducción Acontecimientos adversos notificados en España tras la vacunación (SEFV-H) Respuestas a preguntas frecuentes sobre seguridad de las vacunas frente a COVID-19- No se ha identificado en España o en la Unión Europea ninguna posible reacción adversa hasta ahora desconocida que pueda ser motivo de preocupación.
- A la fecha de cierre de este informe (12 de enero), se habían vacunado en España 494.799 personas, habiéndose recibido 374 notificaciones de acontecimientos adversos. Los más frecuentes incluían acontecimientos relacionados con trastornos generales (fiebre, malestar), sistema nervioso central (cefalea, mareos) y aparato digestivo (náuseas, diarrea).
- La AEMPS seguirá informando de los acontecimientos notificados y de cualquier nueva información relevante que pudiera surgir sobre posibles nuevas reacciones adversas de estas vacunas.
Introducción
El presente informe incluye datos de los acontecimientos adversos ocurridos tras la vacunación con vacunas frente a la COVID-19, notificados en España hasta el 12 de enero de 2021. Adicionalmente también se han incorporado respuestas a preguntas frecuentes sobre la seguridad de este tipo de vacunas, que se irán actualizando periódicamente según sea necesario.
A fecha 12 de enero de 2021, se habían autorizado en la Unión Europea, Comirnaty (Pfizer-BioNTech), autorizada el 22 de diciembre de 2020) y COVID-19 Vaccine Moderna (autorizada el 8 de enero de 2021). En España se está vacunando siguiendo una estrategia de vacunación única en todas las CCAA, cuyo contenido se puede ver en el siguiente enlace: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/COVID19_Vacunacion.htm. Desde el inicio de la campaña de vacunación en España el 27 de diciembre de 2020 hasta el 12 de enero de 2021, se ha administrado únicamente Comirnaty. Esta vacuna está indicada para la inmunización activa para prevenir la COVID-19 causada por el virus SARS-CoV-2, en personas de 16 años de edad y mayores. La ficha técnica y prospecto de estas vacunas se pueden consultar en el Centro de Información Online de Medicamentos de la AEMPS (CIMA).
España, junto con el resto de países de la Unión Europea, coordinados por la Agencia Europea de Medicamentos, está realizando una vigilancia estrecha para detectar y evaluar posibles nuevas reacciones adversas no identificadas durante los ensayos clínicos de las vacunas frente a la COVID-19.
Acontecimientos adversos notificados en España tras la vacunación (SEFV-H)
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), realiza una valoración permanente de los acontecimientos adversos notificados en España tras la vacunación. Estos acontecimientos adversos se registran en la base de datos FEDRA y el objeto de su análisis es identificar posibles nuevas reacciones adversas que deben someterse a una evaluación más amplia y profunda en la Unión Europea para tener la confirmación de que son ocasionadas por la vacuna.
Es esencial tener presente que un acontecimiento adverso es cualquier problema de salud que ocurre después de la vacunación, sin que necesariamente tenga que estar ocasionado por la vacuna, ya que puede tratarse de problemas médicos que coinciden en el tiempo o que estén relacionados con el propio acto de la vacunación.
Los datos que se presentan recogen las notificaciones recibidas en España de acontecimientos adversos ocurridos tras la vacunación frente a la COVID-19 y no se pueden considerar sospechas de reacciones adversas debidas a la vacuna.
Encontrará más información sobre qué es un acontecimiento adverso y cómo se deben de interpretar estos informes en el siguiente enlace.
Acontecimientos adversos notificados en España desde el 27 de diciembre de 2020 hasta el 12 de enero de 2021
Hasta el día 12 de enero de 2021 se vacunaron un total de 494.799 personas, el 70% mujeres. En cuanto a la distribución por grupos de edad, el 62% corresponde a personas de entre 18 y 64 años y el 38% a mayores de 65 años (fuente: Registro de Vacunación, Ministerio de Sanidad).

Figura 1: Distribución de personas vacunadas por grupo de edad y sexo
En este periodo se han registrado en FEDRA un total de 374 notificaciones de acontecimientos adversos, lo que correspondería a 79 notificaciones por cada 100.000 personas vacunadas. El 91% han sido comunicadas por profesionales sanitarios, y el 9% por ciudadanos no profesionales sanitarios.
La mayoría de los casos corresponden a mujeres (83%) y a personas de entre 18 y 64 años (67%).
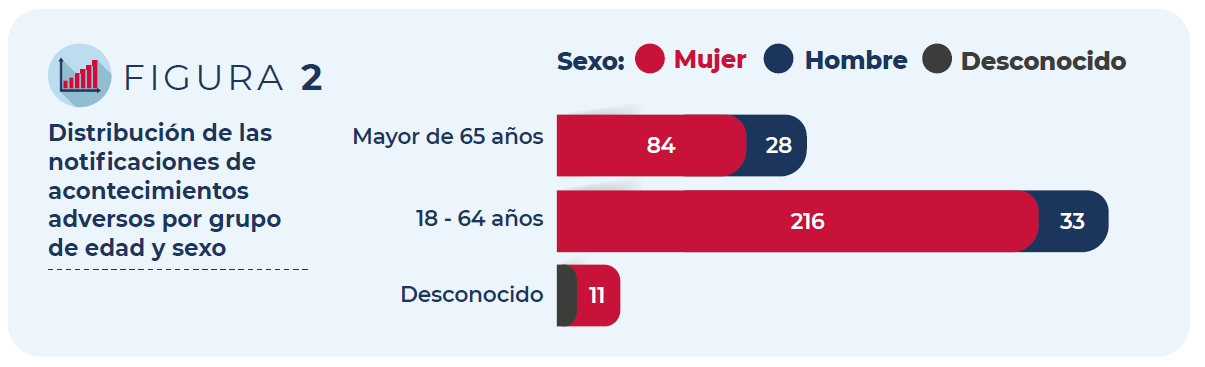
Figura 2: Distribución de las notificaciones de acontecimientos adversos por grupo de edad y sexo
Las 374 notificaciones incluyen 831 términos descriptores de acontecimientos adversos, ya que un mismo caso puede contener varios términos, por ejemplo, una persona puede haber presentado dolor en el lugar de inyección y fiebre tras la administración de la vacuna.
Los trastornos generales como fiebre o malestar general han sido los más frecuentemente notificados, seguidos de los trastornos del sistema nervioso (mayoritariamente cefaleas y mareos) y gastrointestinal (principalmente náuseas y diarrea), independientemente del grupo de edad o sexo de las personas vacunadas.
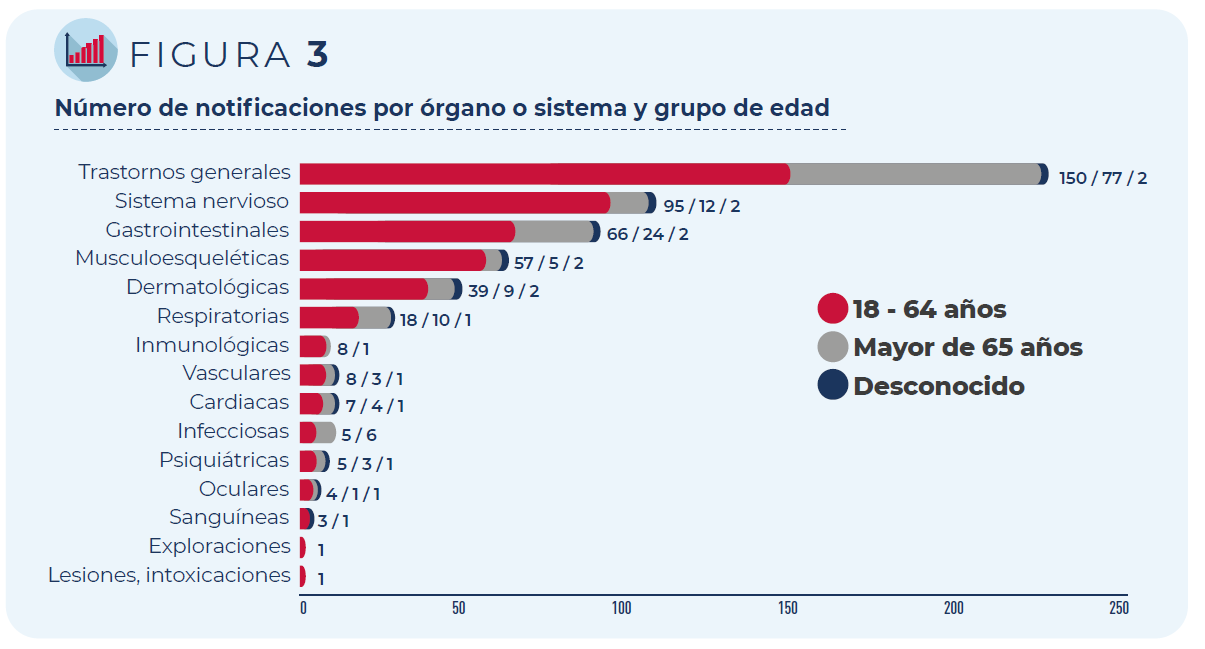
Figura 3. Distribución de las notificaciones por órgano o sistema
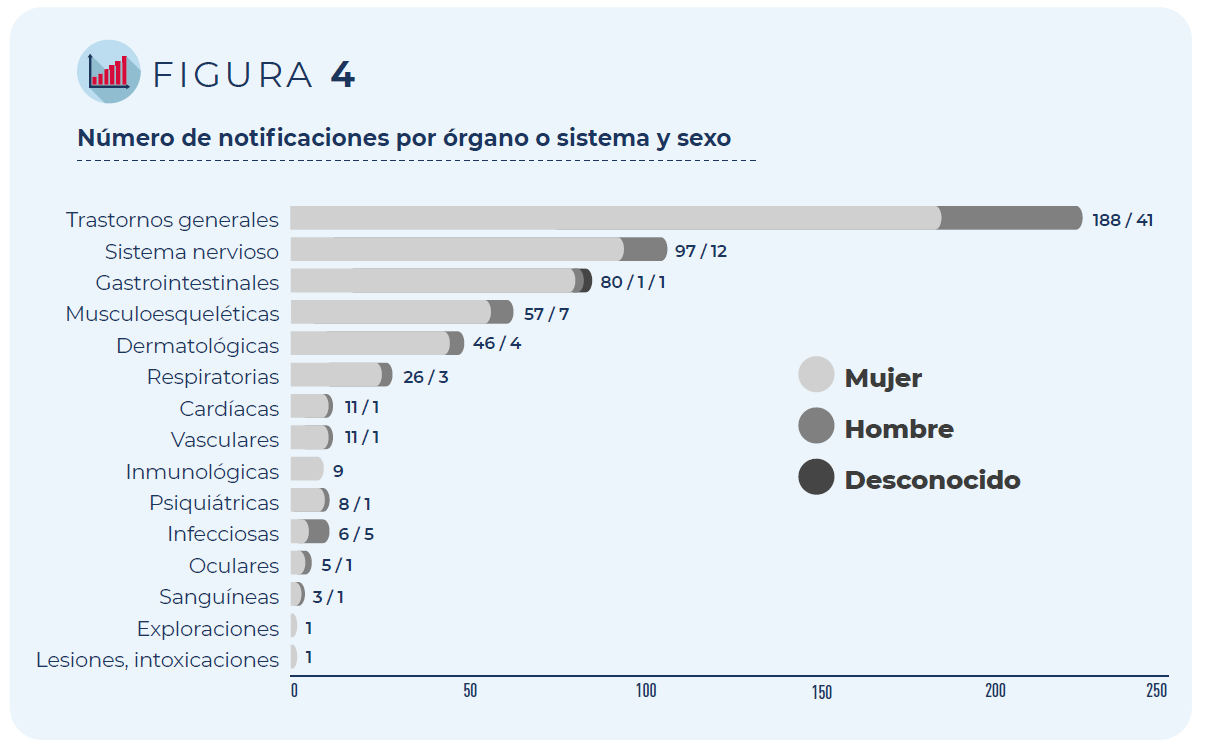
Figura 4. Número de notificaciones por órgano o sistema y sexo
Para información más detallada pueden acceder al informe dinámico a través del siguiente enlace.
La mayor atención en este periodo de tiempo ha estado centrada en los casos de anafilaxia, una reacción adversa conocida y referenciada en la ficha técnica y el prospecto de Comirnaty. Una revisión reciente del Center for Disease Control and Prevention de Estados Unidos estima una tasa de anafilaxia de 11.1 casos por millón de dosis administradas1, en base a las notificaciones recibidas que cumplen con la definición de anafilaxia establecida (Brighton Collaboration2). En España, durante el periodo analizado en este informe, se han identificado 4 casos que cumplen estos criterios de anafilaxia. Todos ellos ocurrieron en mujeres que se recuperaron o estaban en recuperación tras recibir el tratamiento correspondiente. En 3 de los casos constaban antecedentes personales de reacción alérgica.
La anafilaxia es una reacción alérgica grave muy poco frecuente que afecta simultáneamente a varios órganos, principalmente piel, sistema circulatorio y respiratorio. Los principales signos o síntomas incluyen urticaria o eritema generalizado, prurito generalizado con erupción, angioedema, hipotensión, taquicardia, disminución o pérdida de conciencia, sibilancias, estridor, inflamación de las vías respiratorias superiores o dificultad respiratoria. Generalmente aparece a los 15-30 minutos tras el contacto con el agente desencadenante y tiene una progresión rápida. Los síntomas pueden ser graves o amenazar la vida, por lo que es esencial el tratamiento inmediato con adrenalina. Es importante diferenciar una reacción alérgica de un cuadro vasovagal, ya que comparten algunos síntomas, y de otro tipo de reacciones. Encontrará recogida de forma resumida las características que pueden ayudar a diferenciarlos en el siguiente enlace.
Recuerde las recomendaciones de la ficha técnica para identificar estas reacciones y tratarlas precozmente:
- Vigilar la posible aparición de síntomas o signos sugestivos de anafilaxia en la persona vacunada durante al menos 15 minutos tras la vacunación.
- Disponer en los puntos de vacunación de la medicación necesaria para su tratamiento, incluyendo siempre adrenalina, y acceso médico inmediato en caso de que se produzca una reacción alérgica tras la administración de la vacuna.
- No vacunar a personas que tengan hipersensibilidad al principio activo o a alguno de sus excipientes.
Además, la AEMPS recomienda no administrar una segunda dosis de la vacuna a aquellos pacientes que hayan presentado una reacción alérgica clínicamente relevante (anafilaxia, angioedema, urticaria generalizada, manifestaciones respiratorias, como asma o rinitis) tras recibir la primera dosis y derivar al paciente a un servicio de alergología para estudio.
Es importante advertir a las personas vacunadas de que, en caso de aparición de algún síntoma o signo de reacción alérgica tras el periodo de observación, soliciten atención médica.
Pueden ampliar esta información en https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/covid19/COVID19_Vacunacion.htm y en las Recomendaciones FACME para la vacunación frente a COVID-19 en grupos de potencial riesgo.
- Agradecemos su colaboración notificando los acontecimientos adversos tras la vacunación frente a la COVID-19.
- Si tiene que priorizar recuerde que, al igual que con los otros medicamentos, interesan especialmente los acontecimientos adversos graves o no conocidos.
- Para más información sobre la notificación de acontecimientos adversos pulse el siguiente enlace.
Respuestas a preguntas frecuentes sobre seguridad de las vacunas frente a COVID-19
A continuación, encontrará respuestas a preguntas formuladas frecuentemente en relación con la seguridad de las vacunas. Las preguntas de esta sección se irán incluyendo en el apartado de respuestas a preguntas frecuentes relacionadas con la seguridad de vacunas frente a la COVID-19. También se pueden consultar otras preguntas y respuestas sobre la vacunación en los siguientes enlaces institucionales:
Al igual que todos los medicamentos, las vacunas pueden provocar reacciones adversas. No obstante, en los estudios clínicos realizados para su autorización se ha observado que la mayoría de ellas son leves, de corta duración y no todas las personas las sufren.
En las vacunas para las que se necesitará recibir dos dosis, aunque después de recibir la primera aparezca algún efecto adverso leve, no deje de administrarse la segunda, ya que si bien con la primera dosis se consigue cierto grado de protección frente al virus, solo estará realmente protegido cuando reciba la segunda dosis.
Las reacciones adversas más frecuentes identificadas para las vacunas frente a la COVID-19 actualmente autorizadas incluyen:
- Sensación (que suele ser más intensa durante las primeras 24-48h) de dolor, pesadez y/o sensibilidad en el brazo donde se le puso la inyección
- Cansancio, dolor muscular
- Dolor de cabeza
- Malestar general y síntomas leves similares a los de la gripe
- Náuseas
- Fiebre
También puede aparecer inflamación de los ganglios unos días después de la vacunación que puede prolongarse hasta dos semanas. Es una reacción esperable y constituye una señal de que el sistema inmunológico está respondiendo a la vacuna.
En cualquier caso, estos síntomas son leves y suelen durar unos días. Si se prolongan en el tiempo o se agravan, no dude en consultar a su médico.
Puede conocer con más detalle las reacciones adversas que se han descrito para cada una de las vacunas frente a la COVID-19 consultando su ficha técnica y su prospecto, disponibles en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (CIMA). Además, esta Agencia elaborará notas informativas específicas cuando tenga que comunicar nueva información relevante sobre la seguridad de estas vacunas.
19/01/2021
Lo más usual es que las reacciones adversas debidas a las vacunas aparezcan durante los primeros días tras recibir la misma, siendo excepcional que pudieran aparecer después de los primeros meses tras vacunarse. En cualquier caso, se sigue vigilando la seguridad de la vacuna de forma continua para detectar reacciones adversas muy poco frecuentes, las que pudieran ocurrir en poblaciones no incluidas en los ensayos clínicos o aquellas que pudiesen ocurrir tras periodos más prolongados.
19/01/2021
No, los problemas de salud que ocurran tras recibir la vacuna no significa que estén causados por ella; puede tratarse de acontecimientos que hubieran ocurrido igualmente sin haber recibido la vacuna. A modo de ejemplo, por cada millón de habitantes en el año 2018 se produjeron en un periodo de dos meses:
- 205 ingresos hospitalarios debidos a un infarto agudo de miocardio
- 357 ingresos hospitalarios debidos a una enfermedad cerebrovascular aguda
- 77 ingresos hospitalarios debidos a asma
- 123 nuevos casos de epilepsia o convulsiones
- 580 nuevos casos de diabetes mellitus
Fuentes de datos: Cálculo de ingresos hospitalarios: datos de 2018 del Registro de Actividades de Atención Especializada-RAE-CMBD, Subdirección General de Información Sanitaria y datos del INE para población residente en España. Cálculo nuevos casos diagnosticados: datos del programa BIFAP 2018.
En personas mayores de 75 años, estos números son más elevados.
Actualmente, la AEMPS dentro de un gran proyecto europeo, el proyecto ACCESS, y con los datos del Programa BIFAP, se están calculando las frecuencias de aparición de los acontecimientos adversos de especial interés para el seguimiento de la seguridad de las vacunas. Esto permitirá posteriormente vigilar si en la población que reciba la vacuna estas frecuencias se modifican o si el número de acontecimientos adversos que se reciban superan los casos esperados.
29/12/2020
De esto se encarga la farmacovigilancia. Todas las notificaciones de acontecimientos que se reciben se analizan exhaustivamente, revisando con detalle si existen otros factores que puedan haberlos causado y si el número de casos que se notifican es mayor que el que se esperaría que ocurrieran si no se hubiese administrado la vacuna. Esto además se complementa con una evaluación más amplia en la red de agencias de la Unión Europea dentro del Comité Europeo para la Evaluación de Riesgos en Farmacovigilancia, comité que coordina la Agencia Europea de Medicamentos. En esta evaluación se tiene en cuenta todos los datos disponibles a nivel mundial. Las recomendaciones que se deriven de esta evaluación, se aplican en todos los países de la Unión Europea y las nuevas reacciones adversas que se hayan confirmado se incluyen en la ficha técnica y prospecto de la vacuna correspondiente.
29/12/2020
No, no es posible contraer la COVID-19 a través de la vacunación, ya que ninguna de estas vacunas contiene virus vivos.
Lo que sí podría suceder es que una persona vacunada frente a la COVID-19 estuviera incubando la infección o estuviera pasando la enfermedad sin síntomas en el momento de recibir la vacuna. En este caso, y puesto que las vacunas necesitan un tiempo tras su administración para que el organismo desarrolle la protección frente al virus, esta persona, podría transmitir la infección a otros después de haberse vacunado, pero no por haber recibido la vacuna en sí sino por estar infectada previamente.
Tampoco hay que olvidar que ninguna vacuna es eficaz al cien por cien; las de la COVID-19 tampoco lo son, por lo que algunas personas podrían no generar protección frente al virus a pesar de haber sido vacunadas, de tal modo que podrían contraer la enfermedad a pesar de haber recibido la vacuna.
29/12/2020
Puede colaborar notificando cualquier acontecimiento adverso que ocurra después de recibir la vacuna y que sospeche que está relacionado con ella, bien comunicándolo a su profesional sanitario o bien directamente a través de un formulario que encontrará en www.notificaRAM.es.
Si es profesional sanitario y tiene que priorizar la notificación recuerde que, al igual que con el resto de medicamentos, interesan especialmente los acontecimientos adversos graves o no conocidos.
29/12/2020
Es cierto que estas vacunas se han desarrollado gracias a una tecnología muy novedosa ya que contiene material genético del virus, su ARNm. Las vacunas de ARNm funcionan de manera diferente a como lo hacen las vacunas tradicionales. Estas últimas, utilizan antígenos de virus (o bacterias) para “entrenar” al sistema inmune de tal manera que este responda de una manera rápida si entra en contacto con el virus (o la bacteria). Las vacunas de ARNm, por el contrario, no introducen partes del virus en el organismo de la persona vacunada, lo que hacen es proporcionar las instrucciones necesarias para que el organismo humano produzca por sí mismo los antígenos virales y genere defensas contra ellos, de tal manera que cuando entre en contacto con el virus no se desarrolle la enfermedad. Antes del desarrollo de estas vacunas, ya se habían realizado múltiples ensayos con vacunas mRNA en animales y algunos estudios en pacientes. En cualquier caso, es preciso aclarar que todas y cada una de las vacunas frente a la COVID-19, independientemente de la tecnología con la que hayan sido fabricadas, se someten a rigurosas pruebas, controles y estudios antes de su autorización.
19/01/2021
Aunque no hay ninguna indicación de problemas de seguridad con la vacunación de embarazadas, no se dispone de la suficiente información como para recomendar la vacunación a todas las mujeres embarazadas. Por tanto, a la espera de la obtención de más datos y en base al principio de precaución, en términos generales, se recomienda posponer la vacunación de las mujeres embarazadas hasta el final de la gestación. En aquellos casos concretos en los que la mujer tuviese alto riesgo de exposición o riesgo de sufrir complicaciones en caso de contraer la COVID-19, puede valorarse la vacunación de manera individualizada. La decisión de la mujer debe ser voluntaria e informada en función de sus circunstancias específicas.
Tampoco hay datos sobre los posibles efectos de la vacuna durante la lactancia (ni sobre la producción de leche ni sobre el lactante). Teniendo en cuenta que el tipo de vacunas actualmente autorizadas en la Unión Europea (Comirnaty, de Pfizer-BioNTech y la vacuna frente al COVID-19 de Moderna), son vacunas de ARNm que no contienen virus vivos y carecen de capacidad infectiva, no se considera que puedan suponer un riesgo para el lactante, por lo que en el caso de mujeres que amamantan y que tienen alto riesgo de exposición o riesgo de sufrir complicaciones por la COVID-19, al igual que en el supuesto anterior, puede valorarse la vacunación de la madre de manera individualizada con decisión voluntaria e informada de la mujer. No sería necesario suspender la lactancia durante los días posteriores a la vacunación.
En el caso de mujeres que planean un embarazo, como medida de precaución mientras no se disponga de más información, se recomienda esperar al menos 2 semanas tras la administración de la segunda dosis.
19/01/2021
Las personas en tratamiento crónico con anticoagulantes (Sintrom u otros) o que presenten algún trastorno de coagulación pueden vacunarse frente a la COVID-19 ya que esto no supone una contraindicación para la vacunación. No obstante, se deben tomar ciertas precauciones en el momento de la administración de la vacuna para evitar la aparición de hematomas y se debe consultar previamente con el médico para valorar el riesgo de hemorragia según la situación de cada paciente.
19/01/2021
La ficha técnica indica que la vacuna está contraindicada en personas alérgicas a alguno de los componentes de la misma. Tampoco se debe administrar si se ha sufrido una reacción alérgica grave (anafilaxia) a una dosis previa de la vacuna frente a la COVID-19. Puede consultarse la lista de excipientes y principios activos de las vacunas autorizadas en su prospecto, publicado en la web del Centro de Información Online de Medicamentos de la AEMPS (CIMA).
La AEMPS recomienda no administrar una segunda dosis de la vacuna a aquellos pacientes que hayan presentado una reacción alérgica clínicamente relevante (anafilaxia, angioedema, urticaria generalizada, manifestaciones respiratorias como asma o rinitis) tras recibir la primera dosis y derivar al paciente a un servicio de alergología para estudio.
La vacunación no está contraindicada en personas con alergias alimentarias, a medicamentos, animales, insectos, alérgenos del ambiente o látex.
En cualquier caso, es necesario disponer de medicación para el tratamiento de una reacción alérgica y acceso a atención médica inmediata en los puntos de vacunación y se debe garantizar una vigilancia de la persona vacunada durante un periodo de tiempo adecuado. Como medida de precaución general, tras la administración de la vacuna, se mantendrá bajo observación a todos los vacunados durante al menos 15 minutos. En personas con alergias a otras vacunas o a medicamentos con otros componentes diferentes a los de la vacuna frente a la COVID-19, deberá administrarse con precaución manteniendo a los vacunados bajo observación durante un tiempo más prolongado.
19/01/2021
Referencias
1 Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine — United States, December 14–23, 2020. MMWR Morb Mortal Wkly Rep. ePub: 6 January 2021. doi: http://dx.doi.org/10.15585/mmwr.mm7002e1
2 Rüggeberg JU et al. Brighton Collaboration Anaphylaxis Working Group. Anaphylaxis: case definition and guidelines for data collection, analysis, and presentation of immunization safety data. Vaccine 2007; 25(31):5675-84. doi: 10.1016/j.vaccine.2007.02.064 . Epub 2007 Mar 12. PMID: 17448577.

