Índice
- Contenido, interpretación y presentación de los datos
- Casos de sospechas de reacciones adversas notificados en España con tratamientos para COVID-19
- Remdesivir
- Tocilizumab
- Anakinra
- Glucocorticoides
- Heparinas
- Hidroxicloroquina
- Lopinavir/ritonavir
- Interferón beta 1B
- Recomendaciones para la notificación de sospechas de reacciones adversas a medicamentos para el tratamiento de la COVID-19
- Autores
- Bibliografía
Contenido, interpretación y presentación de los datos
El Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), integrado por los Centros Autonómicos de Farmacovigilancia y coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), está realizando un seguimiento estrecho de las sospechas de reacciones adversas notificadas con fármacos utilizados para COVID-19.
La base de datos de sospechas de reacciones adversas, denominada FEDRA, recoge todos los casos que los profesionales sanitarios o la ciudadanía notifican en España, bien sea a través de su centro autonómico de farmacovigilancia, o a través de la industria farmacéutica. FEDRA no recoge casos procedentes de ensayos clínicos. El principal objetivo de la notificación de sospechas de reacciones adversas a medicamentos (RAM) es el de servir como sistema ágil y rápido de identificación de potenciales reacciones adversas no identificadas previamente, o cambios en la forma de presentación de reacciones adversas ya conocidas.
En cuanto a los medicamentos con la indicación autorizada para el tratamiento de la COVID-19, en julio de 2020 se autorizó Veklury®, cuyo principio activo es remdesivir, siendo el primer medicamento con la indicación autorizada para el tratamiento de la COVID-19 (Ver nota AEMPS MUH, 17/2020). En septiembre de 2020 el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) concluyó que existía suficiente evidencia para considerar dexametasona como una alternativa eficaz para el tratamiento de la COVID-19 (Ver nota AEMPS MUH, 28/2020). Ya en 2021 se han autorizado otros medicamentos para su uso en la Unión Europea como Regkirona® (regdanvimab) y Ronapreve® (casirivimab/imdevimab).
Por otro lado, se ha solicitado la indicación para el tratamiento de la COVID-19 de 4 fármacos (tres de los cuáles ya tienen otras indicaciones autorizadas): Kineret® (anakinra), Olumiant® (baricitinib), RoActemra® (tocilizumab) y Xevudy® (sotrovimab). Además, recientemente, la EMA ha iniciado el proceso de autorización acelerada (rolling review) para Evushel® (tixagevimab/cilgavimab) combinación de dos anticuerpos monoclanales y Lagevrio® (molnupiravir), un fármaco antiviral que reduce la capacidad de multiplicación del SARS-CoV-2.
Por último, se han empleado medicamentos autorizados para otras indicaciones terapéuticas, muchos de ellos en el contexto de ensayos clínicos. Las características de los pacientes con COVID-19 difieren de las de aquellos que utilizan estos fármacos para otras indicaciones, pudiendo afectar al perfil de reacciones adversas de estos fármacos. En pacientes con COVID-19 la información de seguridad de los medicamentos más utilizados es muy escasa, por ello es de gran importancia obtener una mayor información.
Al existir varios medicamentos ya autorizados para el tratamiento de la infección por COVID-19, el seguimiento de su seguridad y la información sobre los nuevos riesgos que pudieran ir identificándose, se realizará de la manera habitual, dejándose de realizar a partir de ahora estos informes.
- En las notificaciones de sospecha de reacción adversa, NO hay certeza de que el fármaco sospechoso haya causado la reacción adversa.
- La acumulación de los casos notificados NO puede ser utilizada para calcular la incidencia o para estimar la probabilidad de aparición de reacciones adversas del medicamento.
- La evaluación global de todos los casos notificados de una asociación medicamento-reacción tiene como objetivo únicamente la identificación de potenciales riesgos no conocidos o de cambios en la forma de presentación de las reacciones adversHeas ya conocidas.
Casos de sospechas de reacciones adversas notificados en España con tratamientos para COVID-19
Hasta el 30 de septiembre de 2021 se han registrado en FEDRA un total de 831 casos de sospechas de reacciones adversas con tratamientos utilizados en pacientes diagnosticados de COVID-19. De los 831 casos, 63% proceden de la notificación directa a los Centros Autonómicos del Sistema Español de Farmacovigilancia (SEFV-H) y el 33% restante a través de la industria farmacéutica. La mayoría han sido comunicados a través de la notificación de los profesionales sanitarios, y solo el 20% proceden de casos identificados en estudios observacionales.
De los 831 casos, 161 (19%) se han comunicado por un hospital con un sistema de farmacovigilancia activa que revisa resultados analíticos para detectar posibles reacciones adversas, lo que explica que algunas reacciones adversas referentes a pruebas de laboratorio estén sobrerrepresentadas, como ocurre en los trastornos hepáticos.
La mayoría de los casos corresponden a varones (55%) y el grupo de edad más numeroso corresponde a los adultos (59%). De los 831 casos registrados en el periodo, 560 (67%) fueron considerados graves1.
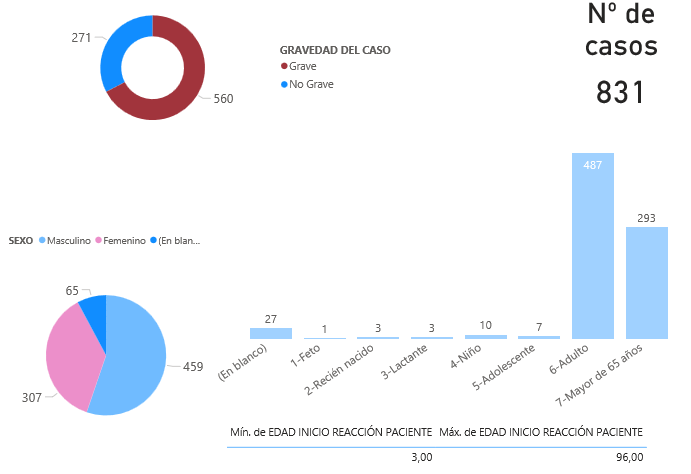
Figura 1: Distribución de los casos notificados en función de la gravedad, sexo o grupo de edad del paciente.
Generalmente los pacientes con COVID-19 reciben combinaciones de varios medicamentos y se pueden considerar sospechosos de haber producido la reacción adversa a todos ellos, sólo a algunos o incluso a otros medicamentos que el paciente estuviera tomando. En algunas ocasiones las reacciones adversas se producen debido a la interacción de varios medicamentos que el paciente está recibiendo.
Todas las notificaciones con fármacos utilizados en COVID-19 son revisadas, incluyéndose en este informe aquellos medicamentos que se han considerado de interés en algún momento de la pandemia y que acumulan al menos de 5 casos, esto es: remdesivir, tocilizumab, glucocorticoides, heparinas, hidroxicloroquina, lopinavir/ritonavir, interferón beta 1b y anakinra. Globalmente corresponden al 91% de los 831 casos recibidos en pacientes diagnosticados de COVID-19.
Los 831 casos describen 1.758 términos de reacciones adversas ya que un mismo caso puede contener varios términos de reacción adversa, por ejemplo, un paciente puede haber presentado una hipotensión y un fracaso renal tras la administración de un fármaco.
Desde el último informe, que analizaba la información hasta el 30 de abril, se han notificado 168 casos nuevos.
| Fármaco | Nº casos nuevos (desde 31 enero 2021) |
Nº casos acumulados (desde 1 marzo 2020) |
|---|---|---|
| Remdesivir | 10 | 77 |
| Tocilizumab | 7 | 127 |
| Glucocorticoides | 9 | 47 |
| Heparinas | 4 | 37 |
| Hidroxicloroquina | 35 | 408 |
| Lopinavir/Ritonavir | 82 | 372 |
| Interferón beta 1B | 1 | 19 |
| Anakinra | 0 | 5 |
Tabla 1: Número de casos de sospechas de reacciones adversas nuevas desde el informe previo y total acumulado para cada fármaco. Sólo se contabilizan los fármacos con al menos 5 casos.
Acceso a la información por medicamentos
Con fecha 9 de julio de 2020, la EMA emitió una autorización de comercialización condicional para remdesivir (Veklury®)2 en el tratamiento de la COVID-19 en adultos y adolescentes (mayores de 12 años con un peso superior a los 40 kg) con neumonía y que requieran oxígeno suplementario (bajo o alto flujo de oxígeno u otra ventilación no invasiva al comienzo del tratamiento)3.
El Comité para la Evaluación de Riesgos en Farmacovigilancia europeo (PRAC, por sus siglas en inglés) de la EMA ha evaluado la señal de insuficiencia renal aguda con remdesivir concluyendo que no existe evidencia suficiente para considerar que los problemas renales estén asociados con el uso de remdesivir. No obstante, seguirá siendo objeto de vigilancia en los informes periódicos de seguridad.
Características de los casos de sospechas de reacciones adversas notificadas
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 77 casos, 10 nuevos desde el último informe. En 57 de los 77 casos, remdesivir figura como único fármaco sospechoso.
De los 77 casos, la mayoría correspondían a adultos varones (40%). El 75% se consideraron graves.
Distribución de los casos de sospechas de reacciones adversas por órgano o sistema
Los 77 casos describen 130 términos de reacciones adversas. Los trastornos hepatobiliares han sido los más frecuentemente notificados (30 casos, 23%).
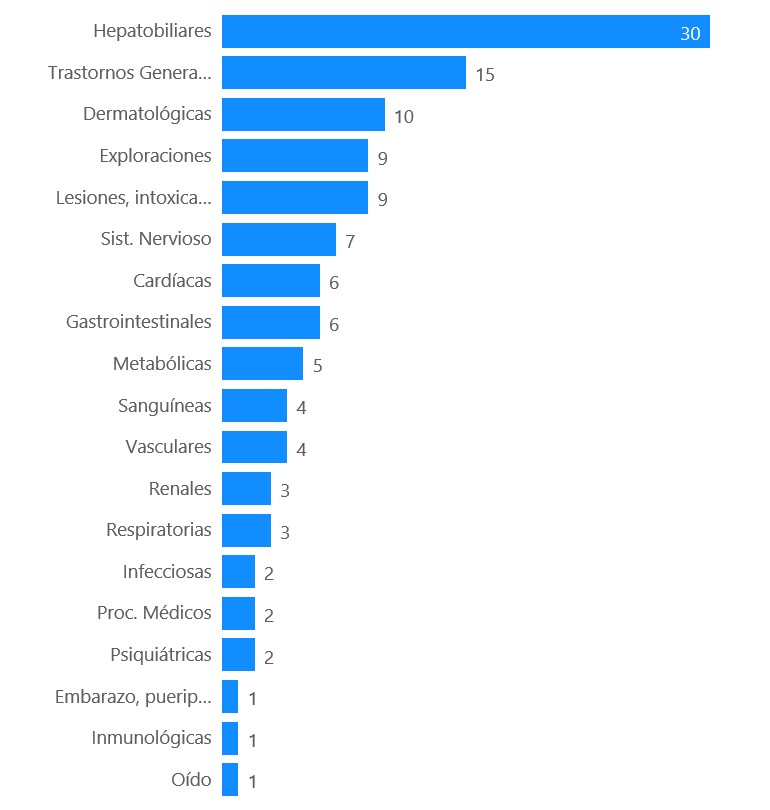
Figura 2: Distribución de los casos por órgano o sistema
Descripción de las reacciones adversas consideradas más relevantes
Trastornos hepatobiliares
De los 77 casos, 30 (23%) fueron trastornos hepatobiliares, incluyendo 44 términos de reacciones adversas codificados como alteraciones de enzimas hepáticas: hipertransaminasemia (10), hepatitis (9), transaminasas elevadas (5), citolisis hepática (5), lesión hepatocelular (3), trastorno hepático (1), hepatitis colestática (2), transaminasa elevada (5), alanina aminotransferasa elevada (2), aspartato aminotransferasa elevada (1) y gammaglutamiltransferasa elevada (1).
La mayoría de los casos corresponden a varones adultos y 27 casos (35%) se consideraron graves.
De los 30 casos, 15 estaban recuperándose en el momento de la notificación, 9 ya recuperados, 2 no recuperados y en 4 se desconoce el desenlace.
En 11 de los 30 casos figuran como sospechosos otros tratamientos que también pueden originar alteraciones hepáticas.
Las alteraciones hepáticas están referenciadas en la ficha técnica de Veklury®3, medicamento que contiene remdesivir, y son actualmente las reacciones adversas más frecuentemente notificadas.
Durante la infección COVID-19, se ha observado la aparición de daño hepático con una incidencia entre 15% y 53%, manifestándose principalmente con incremento de transaminasas acompañado de discretas elevaciones de la bilirrubina4.
Trastornos renales
De los 77 casos notificados, 3 (4%) se refieren a trastornos renales: un caso de fracaso renal e hipotensión con desenlace desconocido, un caso de fracaso renal junto con hipertrigliceridemia y fármaco ineficaz (procedente de una publicación) parece ser asociado a otros tratamientos nefrotóxicos y un caso en combinación con otros fármacos sospechosos de lesión renal aguda y agitación con desenlace mortal.
En la ficha técnica se indica la necesidad de determinar la tasa de filtrado glomerular de los pacientes antes de comenzar el tratamiento y durante el mismo cuando se considere clínicamente adecuado. No se debe utilizar remdesivir en pacientes con una tasa de filtrado glomerular <30 ml/min.
La toxicidad renal grave se ha observado en estudios en animales y el plan de gestión de riesgos de Veklury® considera la toxicidad renal como un riesgo potencial importante5.
Trastornos pancreáticos
Se han notificado un caso grave de pancreatitis en una mujer de 64 años (en combinación con dexametasona) que se ha recuperado con la retirada del remdesivir.
Las alteraciones pancreáticas no están recogidas en la ficha técnica de Veklury®. La infección por SARS-CoV-2 se ha relacionado con la existencia de daño pancreático leve o elevación de enzimas pancreáticas6.
Trastornos cardíacos
Se han notificado 6 casos de bradicardia, 4 de ellos considerados graves. En un caso aparece bradicardia junto con náuseas, cefalea y erupción cutánea, en 5 casos la bradicardia se resuelve tras la retirada de remdesivir y en otro caso el paciente estaba en recuperación en el momento de la notificación.
En la ficha técnica de Veklury® (remdesivir), están recogido taquicardia y bradicardia en el apartado advertencias y precauciones especiales de empleo.
Se recomienda su uso únicamente en el contexto de ensayos clínicos o bajo protocolos definidos que permitan generar evidencias sólidas acerca de su eficacia clínica en el tratamiento de la infección por SARS-CoV-2. El TAC ha solicitado la indicación para el tratamiento de la COVID-19.
Características de los casos de sospechas de reacciones adversas notificados
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 127 casos. A partir del último informe se ha notificado 7 casos. En 29 de los 127 casos, tocilizumab figura como único fármaco sospechoso.
De los 127 casos, la mayoría correspondieron a adultos varones y 123 (97%) se consideraron graves.
Distribución de los casos de sospechas de reacciones adversas por órgano o sistema
Los 127 casos describen 271 términos de reacciones adversas. Los trastornos hepatobiliares han sido los más frecuentemente notificados (55 casos, 22%), seguido de los trastornos hematológicos (33 casos, 15%) y lesiones-intoxicaciones (25 casos, 11%).
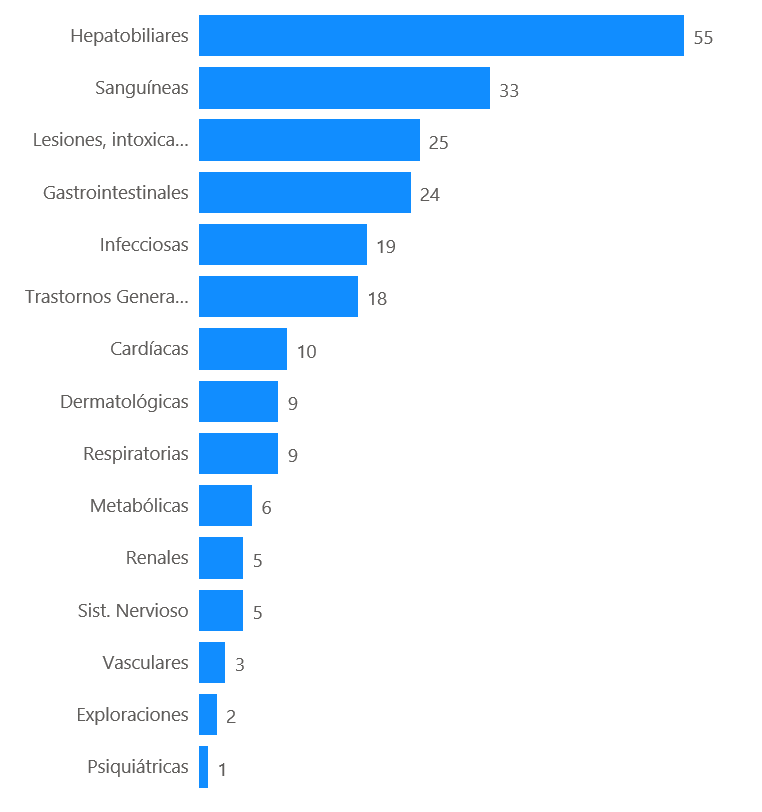
Figura 3: Distribución de los casos por órgano primario
Descripción de las reacciones adversas consideradas más relevantes
Trastornos hepatobiliares
De los 127 casos, 55 (22%) fueron alteraciones hepáticas, incluyendo 62 términos de reacciones adversas hepáticas: hepatitis (35), citolisis hepática (8), hepatitis agudas (4), hiperbilirrubinemias (4), hipertransaminasemias (3), hepatotoxicidad (2), lesión hepática mixta (2), hepatitis tóxica (1), lesión hepática inducida por fármacos (1), prueba de función hepática anormal (1) y transaminasa elevada (1).
Todos los casos se consideraron graves y la mayoría correspondieron a varones adultos. De los 55 pacientes 27 estaban recuperándose en el momento de la notificación, 10 se habían recuperado, 3 no estaban recuperados y 3 pacientes fallecieron; no se conoce el desenlace de 12 pacientes.
En todos los casos, excepto en cuatro, figuran otros tratamientos para la infección por COVID-19 que también pueden originar alteraciones hepáticas.
La ficha técnica de Roactemra® 20mg/ml3, medicamento que contiene tocilizumab, recoge la elevación de transaminasas hepáticas como reacción adversa frecuente. No obstante, en los materiales de minimización de riesgos de este medicamento se informa de que se han observado casos graves de daño hepático incluyendo fallo hepático agudo, hepatitis e ictericia durante el tratamiento7.
Durante la infección por COVID-19, se ha observado en diferentes estudios daño hepático con una incidencia entre 15% y 53%, manifestado principalmente por incremento de transaminasas acompañado de discreta elevación de bilirrubina4.
Trastornos sanguíneos
De los 127 casos, 23 casos describen trastornos sanguíneos. Se han notificado 10 casos de hemorragias, y 5 casos de coagulopatías con tocilizumab como fármaco sospechoso. En 17 de estos 23 casos, se ha notificado además hipofibrinogemia.
Todos los casos fueron considerados graves y la mayoría corresponden a varones adultos. La edad de los pacientes estaba comprendida entre 21 y 83 años.
Los 10 casos de hemorragias describen las siguientes reacciones adversas: hemorragia gastrointestinal (2), hemorragia rectal (2), epistaxis (1), hemorragia de boca (1), hemorragia de herida (1), hemorragia de tracto gastrointesintal (1), melenas (1), y úlcera duodenal con hemorragia (1).
Los 5 casos de coagulopatías describen 3 casos de disminución de la coagulabilidad y 2 casos de coagulopatía con desenlace mortal. Además, se han notificado 5 casos de embolismo pulmonar, cuatro de ellos notificados junto a hipofibrinogenemia. Dos de los pacientes fallecieron.
En el 53% de los casos de hemorragias y coagulopatías se ha notificado también hipofibrinogenemia, reacción adversa frecuente del medicamento. Por otra parte, la propia infección por SARS-CoV-2 podría facilitar la inducción de endotelitis en varios órganos como consecuencia directa de la participación viral8.
En los ensayos clínicos de Roactemra® se identificaron descensos de los recuentos plaquetarios sin episodios hemorrágicos asociados.
Perforaciones intestinales
De los 127 casos, se han notificado 10 casos (8%) de perforación intestinal.
En 8 de los casos las perforaciones intestinales aparecieron entre los 7 y los 30 días tras la administración de tocilizumab. Cuatro de los pacientes fallecieron, 4 estaban en recuperación en el momento de la notificación, uno se recuperó y en el caso restante el desenlace fue desconocido. En 3 de los 4 casos mortales notificados se administró tocilizumab junto a metilprednisolona. El uso de dosis altas de corticoides podría aumentar el riesgo de perforación en pacientes tratados con tocilizumab9.
La mayoría de los casos ocurrieron en varones con edades comprendidas entre 52 y 77 años.
El mecanismo de la perforación intestinal no se conoce, habiéndose señalado como factor de riesgo antecedentes de diverticulitis. En tres de los casos notificados existían indicios de isquemia mesentérica. Las alteraciones hemodinámicas que aparecen en los pacientes graves con COVID-19 podrían conducir a una hipoperfusión intestinal y comprometer la integridad de la mucosa intestinal.
La ficha técnica de Roactemra® describe en el apartado de advertencias y precauciones de uso la posible aparición de perforación intestinal con una incidencia de entre 0,26 y 0,28 acontecimientos por 100 pacientes-años de tratamiento. Estas reacciones fueron comunicadas inicialmente como complicaciones de diverticulitis, tales como peritonitis purulenta generalizada, perforación gastrointestinal inferior, fístulas y abscesos.
Se ha descrito que la perforación intestinal asociada a tocilizumab podría no acompañarse de una elevación de la proteína-C-reactiva y pasar desapercibida inicialmente en pacientes sedados y ventilados10.
Trastornos pancreáticos
Se han notificado 5 casos de pancreatitis aguda y un caso de hiperamilasemia en los que aparece tocilizumab entre los medicamentos sospechosos. Uno de los pacientes también desarrolló hipertrigliceridemia, reacción adversa conocida y poco frecuente. En un caso el único fármaco sospechoso fue el tocilizumab, y además asoció citolísis hepática e hiperbilirrubinemia. La propia infección por SARS-CoV-2 se ha relacionado con la existencia de daño pancreático leve o elevación de enzimas pancreáticas6.
Características de los casos de sospechas de reacciones adversas notificados
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 5 casos. En 2 casos anakinra estaba como único fármaco sospechoso.
De los 5 casos, 4 se consideraron graves y la mayoría correspondieron a adultos varones.
Distribución de los casos de sospechas de reacciones adversas por órgano o sistema
Los 5 casos describen 11 reacciones adversas. Los trastornos hepatobiliares han sido los más frecuentemente notificados (3 casos, 60%), seguido de los sanguíneos (2 casos, 40%) y los trastornos generales (2 casos, 40%).
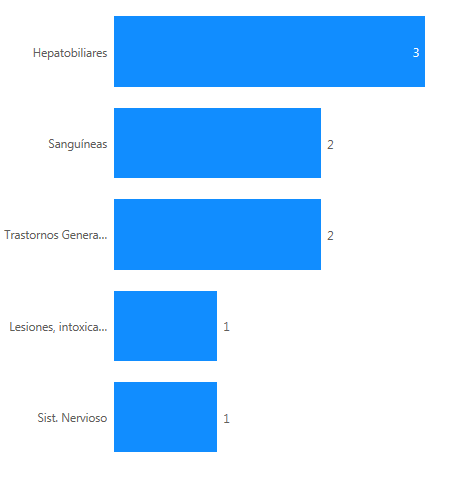
Figura 4: Distribución de los casos por órgano primario
Trastornos hepatobiliares
De los 5 casos, 3 casos (60%) fueron trastornos hepatobiliares. Los 3 casos describen 5 reacciones adversas: hepatitis (2), y un caso con hiperbilirrubinemia, hipertransaminasemia y citolísis hepática. Todos los casos se consideraron graves y todos correspondieron a varones adultos.
De los 3 pacientes, 2 estaban en recuperación y 1 se había recuperado. En 2 casos se incluyen otros fármacos sospechosos de haber producido la reacción.
Durante la infección COVID-19, se ha observado en diferentes estudios daño hepático con una incidencia entre 15% y 53%, manifestado principalmente por incremento de transaminasas acompañado de discreta elevación de bilirrubina4.
Este grupo de medicamentos tiene un perfil de seguridad muy bien establecido y similar para sus diferentes indicaciones terapéuticas.
Características de los casos de sospechas de reacciones adversas notificados
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 47 casos. A partir del último informe se han notificado 9 casos nuevos. Los casos corresponden a metilprednisolona (24 casos), dexametasona (15 casos), prednisona (7 casos), e hidrocortisona (2 casos). En 7 casos, el glucocorticoide era el único fármaco sospechoso.
De los 47 casos, la mayoría correspondían a adultos varones y 42 (89%) se consideraron graves.
Distribución de los casos de sospechas de reacciones adversas por órgano o sistema
Los 47 casos describen 128 términos de reacciones adversas. Los trastornos gastrointestinales (12 casos, 26%) y las lesiones, intoxicaciones (12 casos, 26 %) han sido los más frecuentemente notificados, seguido de los infecciosos (11 casos, 24%).
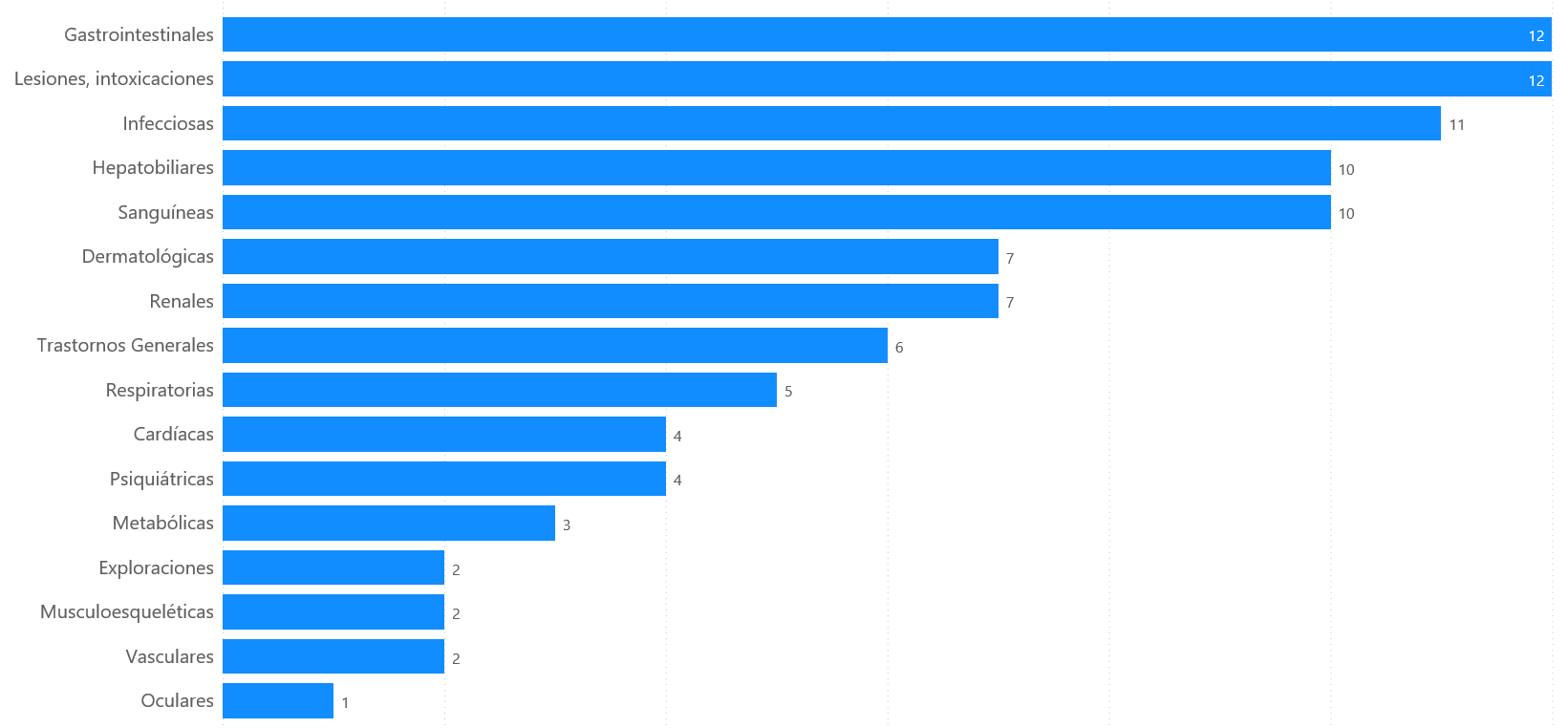
Figura 5: Distribución de los casos por órgano primario
Descripción de las reacciones adversas consideradas más relevantes
Los casos notificados no añaden información novedosa acerca del perfil de seguridad de estos medicamentos.
Trastornos gastrointestinales
De los 47 casos, 12 casos (26%) registraron alteraciones digestivas. Las reacciones adversas fueron: pancreatitis aguda (4), hemorragia gastrointestinal (2), perforación del intestino grueso (2), diarrea (1), hemorragia esofágica (1), náuseas (1), vómitos (1), trastornos gastrointestinales (1).
Todos los casos se consideraron graves y la mayoría correspondieron a mujeres adultas. Seis pacientes se recuperaron, 2 estaban en recuperación, 2 pacientes fallecieron (perforación del intestino grueso en pacientes que también recibían tocilizumab) y en 2 casos se desconoce el desenlace.
En 9 casos hay otros fármacos sospechosos aparte del glucocorticoide.
Trastornos sanguíneos
De los 47 casos, 10 casos (21%) fueron trastornos sanguíneos que incluían 15 reacciones: eosinofilia (4), anemia (4), neutropenia febril (2), coagulopatías (2), hipofribrinogenemia (1), trombocitopenia (1) y leucocitosis (1).
Nueve de los casos fueron graves y mayoritariamente correspondieron a varones adultos y mayores de 65 años.
De los 10 pacientes, 2 se recuperaron, 5 estaban en recuperación, 1 no se había recuperado,1 falleció y en 1 caso se desconoce el desenlace.
En 9 de los casos hay otros fármacos sospechosos además del glucocorticoide.
Trastornos hepatobiliares
De los 47 casos, 10 casos (21%) fueron alteraciones hepáticas: lesión hepática mixta (2), citolísis hepática (1), colestasis (1), hepatitis aguda (1), hepatotoxicidad (1), hipertransaminasemia (1), lesión hepática inducida por fármacos (1), trastorno hepático (1) y un caso de insuficiencia hepática que también contiene alanina aminotransferasa elevada y aspartato aminotrasferasa elevada.
De nuevo, la mayoría de los casos fueron graves y correspondieron a varones.
De los 10 pacientes, 6 se recuperaron, 2 se encontraban en recuperación, 2 casos se desconoce el desenlace y 1 falleció.
En todos los casos hay otros fármacos sospechosos además del glucocorticoide.
Durante la infección COVID-19, se ha observado en diferentes estudios daño hepático con una incidencia entre 15% y 53%, manifestado principalmente por incremento de transaminasas acompañado de discretas elevación de bilirrubina4.
Las heparinas se utilizan ampliamente en pacientes con COVID-19 para prevenir y tratar las complicaciones de la coagulación que se observan en la enfermedad. Estos fármacos tienen un perfil bien establecido en cuanto a sus beneficios y reacciones adversas en sus indicaciones autorizadas.
Características de los casos de sospechas de reacciones adversas notificados
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 38 casos. A partir del último informe se han notificado 5 casos nuevos. Los casos corresponden a en enoxaparina (32 casos), bemiparina (5 casos) y heparina (un caso). En 5 casos, la heparina fue el único fármaco sospechoso.
De los 38 casos, la mayoría correspondían a adultos varones y 34 (89,47%) se consideraron graves.
Distribución de los casos de sospechas de reacciones adversas por órgano o sistema
Los 38 casos describen 74 términos de reacciones adversas. Los trastornos sanguíneos han sido los más frecuentemente notificados (17 casos, 45%), seguido de trastornos hepatobiliares (13 casos, 34%) y gastrointestinales (9 casos, 24 %).
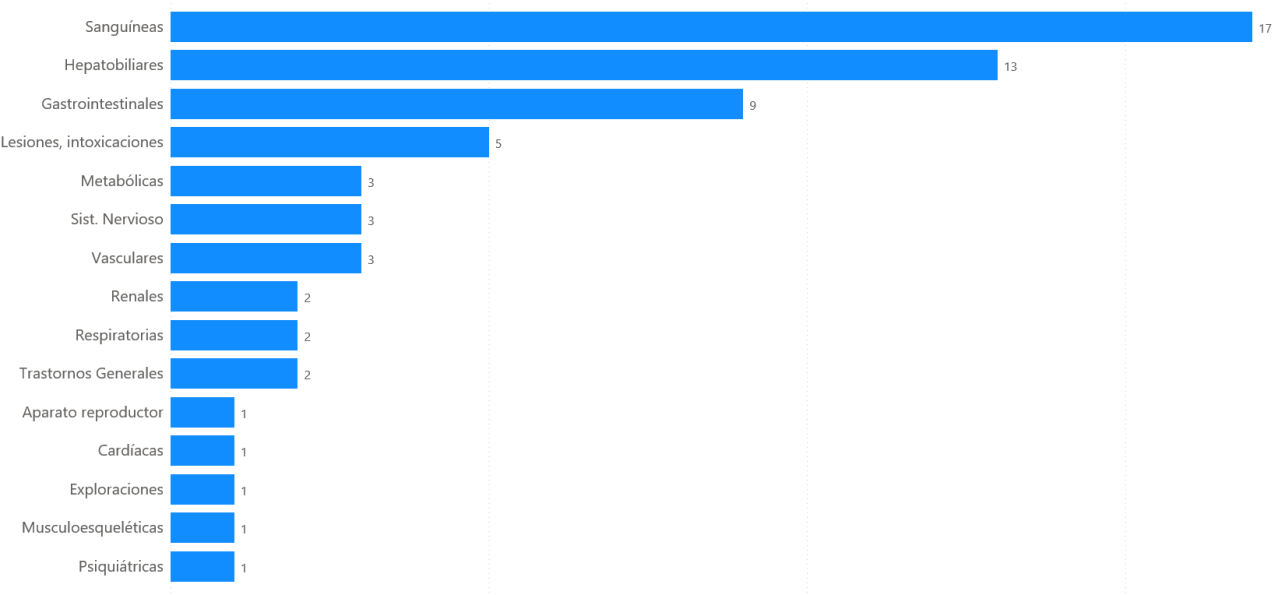
Figura 6: Distribución de los casos por órgano primario
Descripción de las reacciones adversas consideradas más relevantes
Los casos notificados no añaden información novedosa acerca del perfil de seguridad de estos medicamentos.
Trastornos sanguíneos
De los 38 casos, 17 casos (45%) fueron trastornos de la sangre. Las reacciones adversas notificadas fueron: trombocitopenia (8), anemia (5), hipofibrinogemia (4), coagulopatía (2) y trombocitopenia inmune (1).
La mayoría correspondieron a varones adultos y 15 casos (88%) se consideraron graves.
De los 17 pacientes, 8 estaban recuperados, 3 en recuperación, 3 no se habían recuperado, en 2 de los pacientes se desconoce el desenlace y en 1 el paciente falleció. En los 17 casos hay otros fármacos sospechosos además de la heparina.
vEn los 4 casos de hipofibrinogenemia, el tocilizumab constaba como fármaco sospechoso. Esta reacción adversa está descrita en la ficha técnica de RoActemra® medicamento que contiene tocilizumab.Hemorragias
De los 38 casos, 14 corresponden con hemorragias. Las hemorragias están clasificadas en los diferentes órganos o sistemas de MedDRA en función de su localización. Las reacciones notificadas fueron: hipofibrinogenemia (4), hemorragia gastrointestinal (3), anemia por pérdida de sangre (2), hemorragia arterial (2), coagulopatías (2), epistaxis (1), hematoma (1), hematoma muscular (1), hematoma pélvico (1), Hb dismuida (1), hemoptisis (1), hemorragia de la boca (1), hemorragia de la herida (1), hemorragia del tracto gastrointestinal inferior (1), hemorragia en la zona de vasopunción (1), trombocitopenia inmune (1) y úlcera duodenal con hemorragia (1). La mayoría correspondieron con varones de más de 65 años y todos se consideraron graves.
De los 14 pacientes, 5 estaban recuperados, 4 en recuperación, 2 no se habían recuperado, dos pacientes fallecieron y en 1 paciente se desconoce el desenlace.
Trastornos hepatobiliares
De los 38 casos, 13 casos (34%) fueron trastornos hepatobiliares. Los 13 casos describen 14 reacciones adversas: hepatitis (8), hepatitis aguda (3), citolísis hepática (2) e hiperbilirrubinemia (1). Todos los casos se consideraron graves y la mayoría correspondieron a varones adultos.
De los 13 pacientes, 9 estaban recuperados o en recuperación, 2 no se habían recuperado y en 2 se desconoce el desenlace. En los 13 casos hay otros fármacos sospechosos además de la heparina.
Durante la infección COVID-19, se ha observado en diferentes estudios daño hepático con una incidencia entre 15% y 53%, manifestado principalmente por incremento de transaminasas acompañado de discretas elevación de bilirrubina4.
Los resultados de los ensayos clínicos publicados hasta el momento con hidroxicloroquina, como los ensayos clínicos RECOVERY y SOLIDARITY, no apoyan su eficacia antiviral, ni muestran mejoría de la evolución clínica o la mortalidad. En base a estos resultados, la AEMPS suspendió el reclutamiento en los brazos de hidroxicloroquina en aquellos ensayos clínicos que incluyen una población similar a la de los estudios mencionados o en profilaxis post-exposición por ausencia de eficacia11.
Por otra parte, los datos disponibles sugieren un aumento del riesgo de alargamiento del intervalo QT, y también se han descrito, de forma poco frecuente, trastornos neuropsiquiátricos. El 22 de abril, la AEMPS publicó una nota informativa MUH (FV)12, 7/2020 sobre cloroquina e hidroxicloroquina advirtiendo sobre el riesgo de aparición de trastornos del ritmo, y el 14 de mayo se actualizó para advertir del riesgo de aparición de trastornos neuropsiquiátricos graves en pacientes con o sin historia previa de este tipo de trastornos. El 27 de noviembre la EMA anunció la necesidad de actualizar la información sobre los trastornos psiquiátricos para los medicamentos que contienen hidroxicloroquina o cloroquina tras finalizar la revisión de los datos disponibles que confirmaban la asociación entre el uso de estos medicamentos y el riesgo de trastornos psiquiátricos y comportamiento suicida.
Dada la falta de evidencia de eficacia y los potenciales riesgos, actualmente no se recomienda la utilización de hidroxicloroquina en el tratamiento de la infección por SARS-CoV-2.
Características de los casos de sospechas de reacciones adversas notificados
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 408 casos. A partir del último informe se han notificado 35 casos nuevos. De los 35 casos nuevos, la hidroxicloroquina estaba como único fármaco sospechoso en siete pacientes.
De los 408 casos, la mayoría correspondieron a adultos varones y 325 (80%) se consideraron graves.
Distribución de los casos por órgano o sistema
Se han comunicado 408 casos que describen 821 términos de reacciones adversas. Los trastornos hepatobiliares han sido los más frecuentemente notificados (131 casos; 32%), seguidos de los trastornos gastrointestinales (95 casos, 23%), trastornos cardiacos (79 casos, 19%), lesiones, intoxicaciones (78 casos, 19%), trastornos generales (49 casos; 12%), dermatológicos (47 casos, 12%), y trastornos sanguíneos (41 casos, 10%).
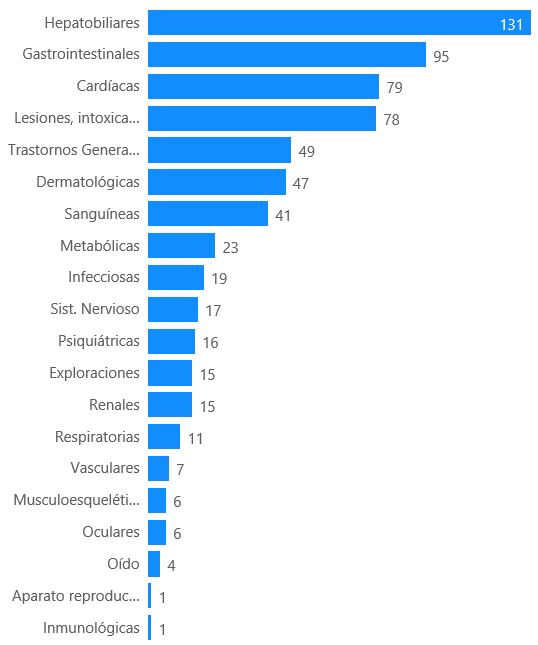
Figura 7: Distribución de los casos por órgano primario
Descripción de los casos considerados más relevantes
Ninguno de los nuevos casos notificados añade información destacable a lo descrito hasta la fecha.
Puede encontrar información adicional en la versión del informe “Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19” publicada el 3 de agosto de 202013.
Los resultados del ensayo clínico RECOVERY14 con lopinavir/ritonavir no muestran eficacia antiviral, ni disminución de la mortalidad de pacientes con COVID-19. Tampoco se observó beneficio clínico en cuanto a la duración de la estancia hospitalaria o progresión a ventilación mecánica. De hecho, se interrumpió definitivamente el reclutamiento de este brazo del ensayo.
Características de los casos de sospechas de reacciones adversas notificados
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 372 casos, 80 de ellos a partir del último informe.
De los 372 casos, la mayoría correspondieron a adultos varones y 224 (60,22%) se consideraron graves.
Distribución de los casos de sospechas de reacciones adversas por órgano o sistema
Se han comunicado 372 casos que describen 913 reacciones adversas. Los trastornos gastrointestinales han sido los más frecuentemente notificados (135 casos, 36%), seguido de lesiones, intoxicaciones (125 casos, 34%), trastornos generales (74 casos, 20%), trastornos hepatobiliares (59 casos, 16%), exploraciones completarías (59 casos, 16%), trastornos cardíacos (58 casos, 16%) y trastornos metabólicos (55 casos, 15%).
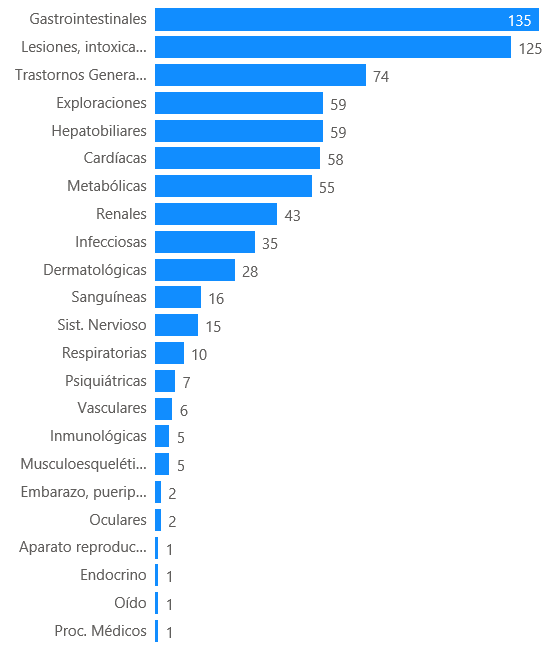
Figura 8: Distribución de los casos por órgano primario
Descripción de las reacciones adversas consideradas más relevantes
Ninguno de los nuevos casos de este periodo añade información relevante a lo descrito hasta ahora.
Puede encontrar información adicional en la versión del informe “Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19” publicada el 3 de agosto de 202013.
Características de los casos de sospechas de reacciones adversas notificados
Desde el inicio del seguimiento (1 de marzo de 2020) se han notificado 19 casos. Desde el último informe se han recibido tres casos nuevos. De los 19, en ninguno el interferón beta-1b estaba como único fármaco sospechoso.
17 casos se consideraron graves y la mayoría correspondieron a adultos varones.
Distribución de los casos de sospechas de reacciones adversas por órgano o sistema:
Los 19 casos describen 52 reacciones adversas. Los trastornos hepatobiliares han sido los más frecuentemente notificados (12 casos, 63%), seguido de trastornos gastrointestinales (5 casos, 26%), lesiones e intoxicaciones (5 casos, 26%) y trastornos generales (5 casos, 26%).
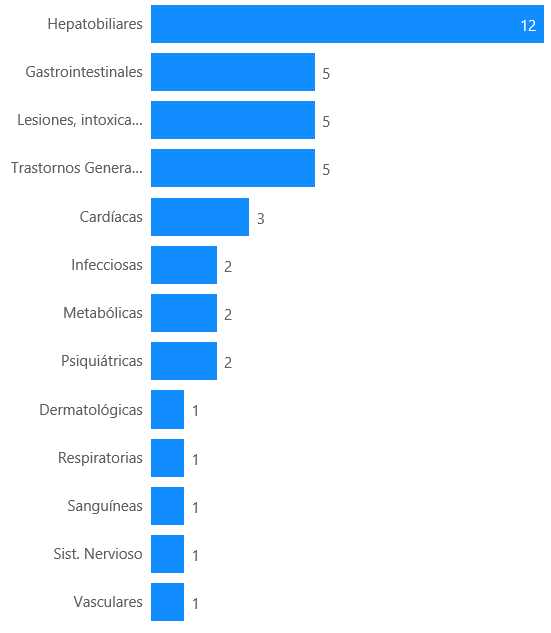
Figura 9: Distribución de los casos por órgano primario
Descripción de las reacciones adversas consideradas más relevantes
Puede encontrar información adicional en la versión del informe “Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19” publicada el 3 de agosto de 202013.
Recomendaciones para la notificación de sospechas de reacciones adversas a medicamentos para el tratamiento de la COVID-19
Se anima a los profesionales sanitarios y a la ciudadanía a notificar las sospechas de reacciones adversas relacionadas con tratamientos utilizados en COVID-19. Para ello, recomendamos el uso del formulario www.notificaRAM.es, así como cualquier otro medio puesto a disposición por su Centro Autonómico de Farmacovigilancia. Para ayudar a interpretar correctamente las notificaciones, es importante reflejar correctamente la siguiente información:- Edad y sexo del paciente.
- Nombre del medicamento, dosis y duración e indicación terapéutica, reflejando si se trata de tratamiento o profilaxis. Para los medicamentos biológicos, indicar el número de lote. Además de los medicamentos que se consideran sospechosos de haber ocasionado la reacción adversa, es conveniente incluir otros medicamentos que pudiera estar tomando el paciente en el mismo periodo.
- Antecedentes clínicos relevantes y estado del paciente debido al COVID-19 en el momento de la reacción adversa (ingresado en UCI, ingresado en planta, paciente ambulatorio).
- Descripción de la reacción adversa con fecha de inicio y finalización, así como el desenlace de la misma en el momento de la notificación.
Autores
Grupo de Trabajo del CTSEFV-H para el seguimiento casos de sospechas de RAM notificados en tratamientos para infección por SARS-CoV-2 (Centros Autonómicos de Farmacovigilancia de Andalucía, Canarias, Cataluña, Comunidad Valenciana, Extremadura, Murcia, Navarra, País Vasco y División de Farmacoepidemiología y Farmacovigilancia de la AEMPS).Bibliografía
1 Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano. Ministerio de Sanidad, Servicios Sociales e Igualdad «BOE» núm. 179, de 27 de julio de 2013 Referencia: BOE-A-2013-8191 2 Veklury. Authorisation details. Disponible en: https://www.ema.europa.eu/en/medicines/human/EPAR/veklury\l authorisation-details-section 3 Ficha técnica del medicamento. Disponible en Centro de Información de Medicamentos (CIMA) de la AEMPS: https://cima.aemps.es/cima/publico/home.html 4 Xu L. et al. Liver injury during highly pathogenic human coronavirus infections. Liver International. 2020;00:1–7. doi: 10.1111/liv.14435 5 EU Risk Management Plan for Remdesivir: https://www.ema.europa.eu/en/documents/rmp/veklury-epar-risk-management-plan_en.pdf 6 Wang F et al, Pancreatic Injury Patterns in Patients With Coronavirus Disease 19 Pneumonia. Gastroenterology. 2020 Jul;159(1):367-370 7 INFORMACIÓN IMPORTANTE DE SEGURIDAD DIRIGIDA A LOS PROFESIONALES SANITARIOS. Disponible en: https://cima.aemps.es/cima/publico/home.html 8 Varga Z, Flammer AJ, Steiger P, Haberecker M, Andermatt R, Zinkernagel AS, et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 2 de mayo de 2020;395(10234):1417-8. 9 Gastrointestinal Perforation AfterTreatment With Tocilizumab: An Unexpected Consequence of COVID-19 Pandemic Mikel Rojo, MD1 et al 10 Vikse J, Henry BM. Tocilizumab in COVID-19: Beware the risk of intestinal perforation. Int J Antimicrob Agents [Internet]. 7 de mayo de 2020; Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7204657/ 11 Nota informativa de medicamentos de uso humano, COVID-19: MUH 15/2020: La AEMPS toma medidas con respecto a los ensayos clínicos para la COVID-19 con hidroxicloroquina https://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/2020/NI-MUH-15-2020-hidroxicloroquina.pdf 12 Nota informativa de medicamentos de uso humano, COVID-19: MUH (FV) 7/2020: Cloroquina/Hidroxicloroquina: precauciones y vigilancia de posibles reacciones adversas en pacientes con COVID. Disponible en: https://www.aemps.gob.es/informa/notasinformativas/medicamentosusohumano-3/seguridad-1/2020-seguridad-1/cloroquina-hidroxicloroquina-precauciones-y-vigilancia-de-posibles-reacciones-adversas-en-pacientes-con-covid-19/ 13 Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19, versión publicada el 3 de agosto de 2020. 14 RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, Linsell L, et al. Dexamethasone in Hospitalized Patients with Covid-19 – Preliminary Report. N Engl J Med. 2020 Jul 17:NEJMoa2021436. doi: 10.1056/NEJMoa2021436Anteriores versiones del documento
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 14 de mayo de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 22 de mayo de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 08 de junio de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 23 de junio de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 6 de julio de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 3 de agosto de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 23 de octubre de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 13 de noviembre de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 14 de diciembre de 2020)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 1 de enero de 2021)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 12 de marzo de 2021)
- Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19 (Publicado el 30 de abril de 2021)

