Última actualización: 08/11/2011
Puede consultar esta nota en formato pdf Fecha de publicación: 8 de noviembre de 2011 Categoría: La AEMPS, MEDICAMENTOS USO HUMANO, INDUSTRIA. Referencia: MUH, 19/2011
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha adoptado una iniciativa para que, una vez que el Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos haya dictado Opinión Positiva para un medicamento centralizado, el Laboratorio Titular de la Autorización de Comercialización pueda con carácter voluntario presentar de forma telemática la «Solicitud de Código Nacional y del Material de Acondicionamiento para la Comercialización en España» a través de la aplicación informática de registro de medicamentos de uso humano RAEFAR.
La AEMPS ha venido implantando una serie de mejoras con objeto de agilizar la tramitación de las autorizaciones y modificaciones de comercialización de
medicamentos. Estas mejoras se quieren extender ahora también a los medicamentos que se tramitan por la Agencia Europea de Medicamentos a través del procedimiento centralizado, cuya autorización culmina con la preceptiva Decisión de la Comisión Europea, y que implica que la AEMPS asigne el código
nacional para cada presentación, tras la revisión de una parte del material de acondicionamiento, y notifique todo ello tanto al TAC como a la Dirección General de Farmacia y Productos Sanitarios (DGFPS).
La participación voluntaria del titular en la inclusión de la información de registro en RAEFAR, a la cual se adjuntará la solicitud de Código Nacional y
del Material de Acondicionamiento, contribuye a disminuir la carga de trabajo administrativo de la AEMPS y permite a su vez integrar la documentación en los nuevos sistemas de notificación automatizada de la Agencia, mejorando así todo el proceso.
El TAC también se podrá acoger a este nuevo proceso de inclusión de información en RAEFAR con posterioridad a la Decisión de la Comisión, para cualquier otra presentación ya autorizada por la Agencia Europea de Medicamentos que pretenda comercializar.
En todo caso, para aquellos medicamentos en los que su titular decida no acogerse a esta iniciativa, la AEMPS seguirá realizando la carga en RAEFAR. El
titular podrá enviar la «Solicitud de Código Nacional y del Material de Acondicionamiento para la Comercialización en España» después de la Decisión de la Comisión, tal como se viene realizando hasta ahora, es decir, presentando la documentación por Registro General, pero en formato electrónico. A partir de ese momento la AEMPS procederá a revisar el material presentado y notificar la «Comunicación del Código Nacional» para la comercialización en España, y a la carga de las bases de datos.
En consecuencia, los titulares de medicamentos que se tramiten por procedimiento centralizado interesados en seguir la presente instrucción deberán ajustarse a lo siguiente:
(1) AUTORIZACION INICIAL
1.1. Envío de la solicitud
Tras la emisión de la Opinión Positiva del CHMP, el titular podrá presentar telemáticamente la «Solicitud de Código Nacional y del Material de Acondicionamiento para la Comercialización en España» a través de RAEFAR. Para proceder a dicha presentación, se debe realizar la carga del formulario de RAEFAR para Nuevos Medicamentos, siendo imprescindible rellenar los apartados marcados como obligatorios para los productos centralizados que figuran en negrita y presentar, paralelamente al envío de este formulario, la siguiente documentación:- Copia de la Opinión del CHMP para dicho medicamento.
- Copia de la versión vigente de los Datos Administrativos Europeos (obtenida del expediente eCTD del dossier europeo de registros para este medicamento).
- Copia firmada del formulario RAEFAR en formato pdf.
- Textos en inglés y en español acordados tras la etapa de revisión de Comentarios Lingüísticos (Día 237 del procedimiento EMA Post-opinión).1
- Propuesta de las maquetas del embalaje exterior para las presentaciones que se pretenden comercializar en España. El código nacional deberá aparecer como XXXXXX.X. En caso de que en el momento de esta presentación el laboratorio no conozca aún el número europeo de registro para cada presentación, éste se podrá indicar en la maqueta como EU/X/XX/XXX/XXX.
- Si procede, Certificado Braille correspondiente a dichas presentaciones.
1.2. Envío de la Decisión de la Comisión
Si la solicitud se hubiera presentado previamente a la Decisión de la Comisión, una vez que el laboratorio obtenga la Decisión de la Comisión para el medicamento, se deberá presentar una nueva secuencia NEES con copia de dicha Decisión de la Comisión.1.3. Notificación de la AEMPS
Si se ha seguido el proceso descrito, la AEMPS enviará en un plazo máximo de 7 días, a contar desde la presentación de la secuencia con la Decisión, y siempre que los materiales sean correctos, la Notificación de «Comunicación del Código Nacional para la comercialización en España». La AEMPS ha trabajado e implementado el desarrollo informático necesario para que el laboratorio reciba dicha Notificación por vía electrónica, mediante un e-mail de aviso al correo que el Laboratorio indique en los apartados 2.4.1., 2.4.2. y 2.4.6. del/de los formulario(s) RAEFAR presentado (Titular, Persona designada por el Titular y Representante local). Dicha Comunicación de Resolución incluirá el código nacional asignado a la presentación para la que se solicitó. Igualmente, la AEMPS ha desarrollado e implementado una comunicación automática y electrónica con la DGFPS, para que ésta reciba copia de dicha notificación de «Comunicación del Código Nacional para la Comercialización en España» en el mismo momento que se envía dicha comunicación electrónica al laboratorio.1.4. Comunicación de comercialización efectiva
De acuerdo con lo establecido en el artículo 28 del RD 1345/2007, el Laboratorio Titular debe comunicar de forma expresa a la AEMPS la fecha de comercialización efectiva de cada medicamento, como mínimo quince días antes de efectuarse dicha comercialización. Para señalar la fecha de comercialización efectiva se empleará la aplicación «Notificaciones sobre comercialización de medicamentos».2(2) MODIFICACIONES DE AUTORIZACION
2.1. Notificación de la modificación
Para aquellas modificaciones de los medicamentos centralizados que deban ser notificadas a la AEMPS, tal como se indica en el anexo 2 de la presente instrucción, una vez obtenida la autorización de la autoridad competente, cuando proceda, el laboratorio utilizará la pestaña de RAEFAR habilitada para enviar estas notificaciones (SOLICITUD/VARIACIONES/MODIFICACIONES CENTRALIZADOS). En el Anexo 3 se muestra un ejemplo de la información a introducir por cada presentación, a la cual se adjuntará un envío de una Secuencia NEES que incluya la documentación pertinente en cada caso (Copia de la Decisión de la Comisión, textos nuevos, si procede, etc.). Para cualquier duda, se deberá dirigir al correo electrónico «edossier@aemps.es«.2.2. Transmisión de la información a la DGFPS
Una vez recibida esta comunicación por la AEMPS, ésta procesará la información, actualizará, si procede, la base de datos RAEFAR, y enviará en su caso, de manera automática, una comunicación a la DGFPS, dando cuenta de este traslado, asimismo, al titular.ANEXO 1. Modelo de secuencia NEES para realizar el envío del formulario de RAEFAR
Ejemplo de un envío para 3 presentaciones: 100 comprimidos, 60 comprimidos y 20 comprimidos.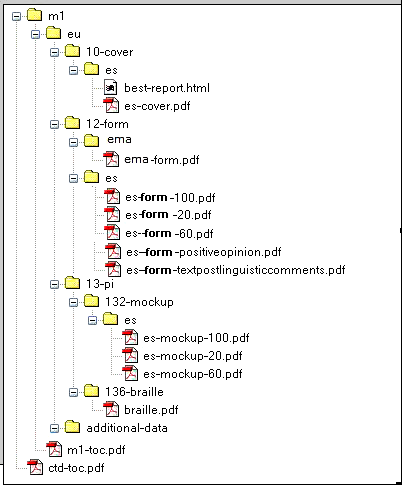
ANEXO 2. Relación de modificaciones que deben ser notificadas a la AEMPS para su traslado posterior a la DGFPS, si procede
- Cambio del Titular o la dirección.
- Cambio de representante local o de la dirección.
- Cambio del nombre del medicamento.
- Cambio, supresión o nueva indicación terapéutica.
- Cambio o nueva posología.
- Cambio en el grupo terapéutico (ATC).
- Otros cambios relevantes en la ficha técnica (FT).
- Cambio de diseño del material de acondicionamiento.
- Comunicación de la anulación de un medicamento o suspensión temporal de comercialización.
ANEXO 3. Ejemplo de notificación de modificaciones de la autorización de comercialización de medicamentos autorizados por procedimiento centralizado en RAEFAR
NOTA: Realizar un envío por presentación (EU/1/11/XXX/001). CAMPO DE TEXTO LIBRE A COMPLETAR EN RAEFAR:Producto y Breve descripción de la variación (por ejemplo: Nueva indicación, Cambio del Código ATC, Cambio de titular, Cambio del Representante local, etc.).
Con fecha (día) de (mes) de (año) el laboratorio (Titular de la Autorización) ha recibido la Decisión de la Comisión para la modificación de (motivo de la modificación) para el/los medicamento(s) (Nombre del medicamento). En España dicha modificación afecta a la(s) siguientes presentación(es) de dicho(s) medicamento(s):- Presentación 1 del Medicamento / Nº de Registro Europeo / C.N.
- Copia de la Decisión de la Comisión para dicha variación.
- Copia de la versión vigente de los Datos Administrativos Europeos (obtenida del expediente eCTD del dossier europeo de registros para este medicamento) (Si el cambio afecta a los datos administrativos – ej.: cambio de código ATC).
- Copia de la Información del Producto en español emitida con la Decisión de la Comisión (Anexos I-III) (Si el cambio afecta a dichos Anexo – por ej., cambio de indicación).
ANEXO 4. Instrucciones para los Titulares de la Autorización de Comercialización y Representantes Locales en lo relativo a los permisos de inclusión de datos de RAEFAR
La inclusión de datos en RAEFAR debe ser realizada por el Titular de la Autorización de Comercialización empleando medios propios o autorizando a un tercero que deberá contar con certificado de la Fábrica de Moneda y Timbre para cargar en RAEFAR los medicamentos de dicho Titular. Puede encontrar el formulario de solicitud de acceso y la información detallada sobre cómo realizar esta solicitud en la web de la AEMPS, sección Oficina virtual.Instrucciones en relación a los datos de RAEFAR que no están dados de alta en las tablas predeterminadas de dicha Base de Datos
Para aquellos datos que no estén dados de alta en las tablas predeterminadas de RAEFAR, tales como principio activo, código ATC, Laboratorio Titular, etc.; el Laboratorio deberá enviar un correo electrónico a «edossier@aemps.es«, adjuntando la documentación que avale la inclusión de dichos datos en RAEFAR (por ejemplo: datos administrativos europeos y/o copia del establecimiento del titular en la UE, etc.). De esta forma, dichos datos se darán de alta en las correspondientes tablas predeterminadas, para que el laboratorio pueda seleccionarlos en el campo correspondiente del formulario de RAEFAR a la hora de completar el mismo.- Ver EMA/5542/02/Rev 4.1.: The linguistic review process of product information in the centralised procedure – human
- https://sinaem.agemed.es/WebComercializacion/login.aspx?opc=humana
- https://sinaem.agemed.es/WebComercializacion/login.aspx?opc=humana
Si desea localizar información relacionada con el contenido de esta página,
utilice el buscador

