Última actualización: 3/10/2017
Puede consultar esta nota en formato pdf
Ampliación de la Nota Informativa con Referencia: SG, 4/2017 Fecha de publicación: 31 de julio de 2017
Fecha de publicación: 3 de octubre de 2017
Categoría: INDUSTRIA, MEDICAMENTOS DE USO HUMANO
Referencia: SG, 7/2017
Puesta en marcha de las novedades en el envío y carga de las propuestas de los textos con la información del medicamento y las traducciones para su revisión durante la fase nacional de los procedimientos de solicitud de autorización de comercialización y procedimientos de modificación posteriores.
La AEMPS ha finalizado la adaptación de sus aplicaciones para la puesta en marcha de las novedades en el envío y carga de las propuestas de textos con la información del medicamento y las traducciones para su revisión durante la fase nacional de los procedimientos europeos
La AEMPS decidió eliminar la obligatoriedad del envío de la secuencia de textos propuestos (secuencia 9xxx en procedimientos europeos y secuencia correlativa en registros nacionales), incluyendo también la novedad de la generación automática por parte de la AEMPS de la secuencia 8xxx. Esta propuesta permitirá evitar las tareas reiterativas que suponían hasta ahora el envío de las secuencias conteniendo los textos propuestos y la inclusión posterior de los mismos a través de la herramienta de fraccionamiento.
Para una correcta automatización de las cargas, las propuestas de textos y traducciones (cuando proceda) deberán tramitarse como se describe a continuación:
-
SOLICITUDES RELATIVAS A MEDICAMENTOS AUTORIZADOS POR PROCEDIMIENTO DESCENTRALIZADO Y RECONOCIMIENTO MUTUO (Nuevos Registros, Variaciones MRP/ DCP, incluyendo Notificaciones Articulo 61(3) y Revalidaciones Quinquenales MRP/DCP
En estos casos, las propuestas de textos (traducciones), se cargarán en la herramienta de fraccionamiento
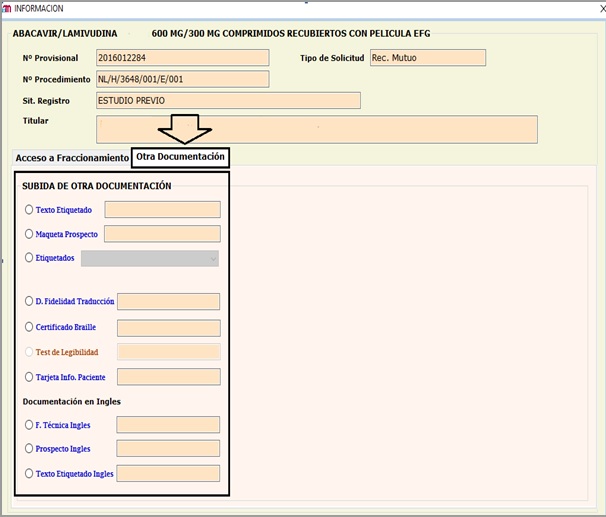
En el caso de solicitudes de Medicamentos Autorizados Por Procedimiento Descentralizado Y Reconocimiento Mutuo (Nuevos Registros, Variaciones, incluyendo Notificaciones Articulo 61(3) y Revalidaciones Quinquenales se ha habilitado la opción de la presentación a través de una nueva pestaña denominada (“Otra Documentación”) de los siguientes documentos
(VER ANEXO I)
- Propuesta de traducciones de ficha técnica y prospecto.
- Propuesta de traducción del etiquetado en Word.
- Propuesta de maquetas de etiquetado y prospecto.
- Declaración acreditativa de la fidelidad de la traducción.
- Certificado Braille firmado.
- Textos finales del procedimiento en inglés.
Los documentos habilitados para su subida, en cada caso, serán los marcados en color azul, permaneciendo inactivos los que no procedan, según el tipo de procedimiento. Hacer clic en cada uno, tendrá opción de adjuntarlo desde una ubicación específica o arrastrar y cargar directamente el archivo.
Opcionalmente podrá seguir enviándose como se venía haciendo hasta ahora, de forma puntual y previa petición por parte del solicitante a la AEMPS.
Una vez finalizada la evaluación de los textos a través de la herramienta de fraccionamiento, se generará desde la AEMPS la secuencia automática 8xxx con los textos definitivos finales y maquetas acordadas.
Esta secuencia incluirá también los documentos descritos anteriormente que se presenten mediante la herramienta del fraccionamiento.
-
SOLICITUDES RELATIVAS A MEDICAMENTOS AUTORIZADOS POR PROCEDIMIENTO NACIONAL Y SUS POSTERIORES MODIFICACIONES
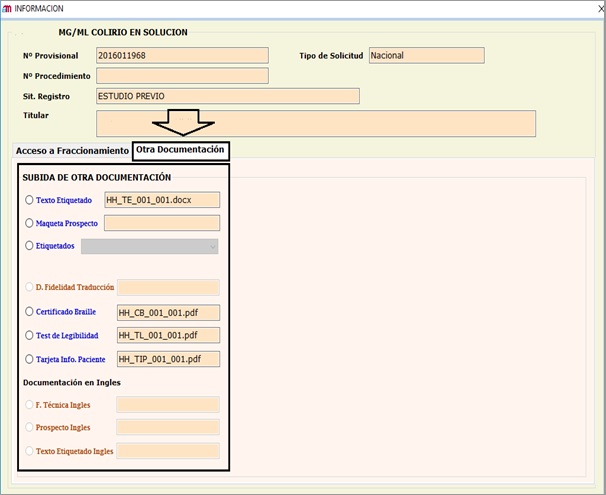
Para estos procedimientos, igualmente se ha habilitado la opción de la presentación a través de una nueva pestaña denominada (“Otra Documentación”) de los siguientes documentos
(VER ANEXO II)
- Propuesta de ficha técnica y prospecto.
- Propuesta del etiquetado en Word.
- Propuesta de maquetas de etiquetado y prospecto.
- Certificado Braille firmado.
- Test de legibilidad.
Al igual que en el caso anterior, los documentos habilitados para su subida, en cada caso, serán los marcados en color azul, permaneciendo inactivos los que no procedan, según el tipo de procedimiento. Hacer clic en cada uno, tendrá opción de adjuntarlo desde una ubicación específica o arrastrar y cargar directamente el archivo.
Una vez finalizada la evaluación de los textos a través de la herramienta de fraccionamiento, se generará desde la AEMPS la secuencia automática 8xxx con los textos definitivos finales y maquetas acordadas.
Esta secuencia incluirá también los documentos descritos anteriormente que se presenten mediante la herramienta del fraccionamiento.
IMPORTANTE:
Para evitar problemas de confidencialidad, en el caso de que se desee cambiar la persona de contacto para este tema (ej. CROs, Futuro TAC en España, etc.), junto con la propuesta de textos deberá enviarse una autorización del solicitante que habilite a la nueva persona de contacto para llevar a cabo la revisión de los textos con la AEMPS a través de la herramienta de fraccionamiento.
En caso de necesitar más información puede dirigirse a edossier@aemps.es.
ANEXO I
Solicitudes relativas a medicamentos autorizados por Procedimiento Descentralizado y Reconocimiento Mutuo
ANEXO II
Solicitudes relativas a medicamentos autorizados por Procedimiento Nacional y sus posteriores modificaciones
Si desea localizar información relacionada con el contenido de esta página, utilice el buscador

