Última actualización: 10/10/2016
Puede consultar esta nota en formato pdf
Modificación de 10 de octubre de 2016 (ver nota al final)*
Fecha de publicación: 21 de julio de 2016
Categoría: INDUSTRIA, MEDICAMENTOS VETERINARIOS
Referencia: MVET 6/2016
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha implementado una iniciativa para que, una vez adoptada la Decisión de la Comisión Europea (CE) por la que se concede la autorización de comercialización para un medicamento veterinario autorizado por procedimiento centralizado, el Titular de la Autorización de Comercialización (TAC) pueda presentar telemáticamente la «Solicitud de Código Nacional para la Comercialización en España» a través de RAEVET II.
La AEMPS ha venido implantando una serie de mejoras con objeto de agilizar la tramitación de las autorizaciones y modificaciones de comercialización de los medicamentos. Estas mejoras se quieren extender ahora también a los medicamentos que se tramitan por la EMA a través del procedimiento centralizado, cuya autorización culmina con la preceptiva Decisión de la CE, y que implica que la AEMPS asigne el código nacional para cada formato y lo notifique al TAC.
La participación del TAC en la inclusión de la información de registro en RAEVET II, a la cual se adjuntará la solicitud de código nacional (CN), contribuye a disminuir la carga de trabajo administrativo de la AEMPS y permite a su vez integrar la documentación en los nuevos sistemas de notificación automatizada de la AEMPS, mejorando así todo el proceso.
El TAC también se podrá acoger a este proceso de solicitud de registro en RAEVET II con posterioridad a la Decisión de la CE, para cualquier otra presentación ya autorizada que pretenda comercializar.
Los TAC de medicamentos que se tramiten por procedimiento centralizado deberán ajustarse a lo siguiente:
-
AUTORIZACION INICIAL
-
Envío de la solicitud
Dictada la Decisión de la CE por la que se autoriza el medicamento, el solicitante presentará telemáticamente la «Solicitud de Código Nacional para la Comercialización en España» a través de RAEVET II. Para ello, se debe realizar la correspondiente solicitud a través de la pestaña “Comunicación de Centralizados” disponible en RAEVET II, indicando en los campos correspondientes de la solicitud el número de procedimiento global asignado por la EMA “EMA/C/V/XXXXXX, el del medicamento (EU/2/XX/XXX) y el/los formato/s a comercializar (EU/2/XX/XXX/001-00X).
En la secuencia se incluirá un formulario de solicitud eAF por cada concentración y forma farmacéutica para nuevas autorizaciones de medicamentos que se pretendan comercializar en España. Asegúrese de utilizar la versión vigente en el momento de la solicitud, disponible para su descarga en la web de Eudralex o en esubmission, siendo imprescindible rellenar los apartados marcados como obligatorios para los medicamentos centralizados. En el caso de, por ejemplo, no estar disponible el código ATCvet, se indicaría el facilitado provisionalmente. Se recomienda encarecidamente remitir un solo eAF por cada forma farmacéutica y concentración, que incluya, en la sección 2.2., los formatos asociados a esa forma farmacéutica y concentración que tengan intención de comercializar.
El-los eAF debidamente cumplimentado-s, bloqueado-s y guardado-s en formato digital se incluirán en la carpeta P1/1a-admin-info/.
Se estructurará como una secuencia VNeeS, incluyendo toda la documentación dentro de la Parte 1. Como anexo 1 a esta instrucción, se incluye un modelo de secuencia VNeeS, para realizar dicho envío.
- Para cualquier duda sobre la carga en RAEVET II se debe dirigir al correo electrónico “edossierv@aemps.es”.
-
Notificación de la AEMPS
Si se ha seguido el proceso descrito, la AEMPS notificará al TAC mediante la «Comunicación del Código Nacional para la comercialización en España».
La AEMPS ha puesto en marcha el desarrollo informático necesario para que se reciba dicha notificación por vía electrónica, mediante un mensaje de aviso a la dirección de correo electrónico que el solicitante indique en los apartados 2.4.1., 2.4.2. y 2.4.6. del/de los formulario(s) eAF presentado/s (TAC, Persona designada por el TAC y Representante local). Dicha comunicación de resolución incluirá el código nacional asignado al formato para el que se solicitó.
-
Comunicación de comercialización efectiva
De acuerdo con lo establecido en el artículo 27 del RD 1246/2008, el titular debe comunicar de forma expresa a la AEMPS la fecha de comercialización efectiva de cada medicamento, como mínimo quince días antes de efectuarse dicha comercialización. Para señalar la fecha de comercialización efectiva se empleará la aplicación «Aplicación informática de Comercialización de Medicamentos Veterinarios» (*)
-
-
MODIFICACIONES DE AUTORIZACIÓN
-
Notificación de la modificación
Para aquellas modificaciones de los medicamentos centralizados que deban ser notificadas a la AEMPS, tal como se indica en el anexo 2 de la presente instrucción, una vez obtenida la autorización de la autoridad competente, cuando proceda, el solicitante utilizará la pestaña de RAEVET II, habilitada para enviar estas notificaciones (SOLICITUD/MODIFICACIONES CENTRALIZADOS (V-09)).
En el anexo 3 se muestra un ejemplo de la información a introducir por cada formato, a la cual se adjuntará un envío de una secuencia VNeeS que incluya la documentación pertinente en cada caso.
Para cualquier duda, se deberá dirigir al correo electrónico “edossierv@aemps.es”
-
ANEXO 1. Modelo de secuencia VNeeS para realizar envío del formulario a través de RAEVET II
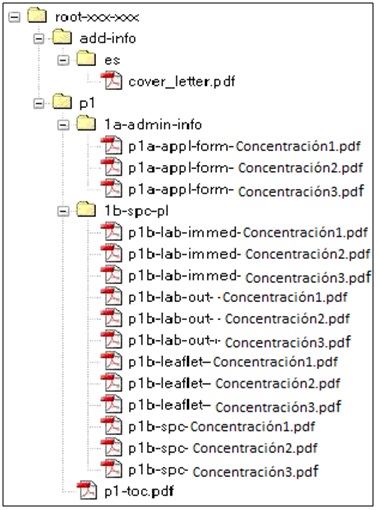
ANEXO 2. Relación de modificaciones que deben ser notificadas a la AEMPS:
- Cambio del titular o la dirección.
- Cambio de representante local o de la dirección.
- Cambio del nombre del medicamento.
- Cambio, supresión o nueva indicación terapéutica.
- Cambio, supresión o nueva especie de destino.
- Cambio, supresión o nueva forma farmacéutica.
- Cambio del tiempo de espera.
- Cambio del periodo de validez.
- Cambio en el grupo terapéutico (ATCvet).
- Otros cambios relevantes en la ficha técnica (FT).
- Comunicación de la anulación de un medicamento.
- Comunicación de la suspensión temporal de comercialización.
En el caso de la comunicación de la anulación o suspensión de comercialización de un código nacional, el solicitante debe además emplear la aplicación «Aplicación informática de Comercialización de Medicamentos Veterinarios» (*).
Para tramitar un nuevo formato de un medicamento ya comercializado en España se deberá presentar en RAEVET II una nueva solicitud de código nacional y seguir el mismo proceso que se especifica en este documento. Asimismo, se deberá comunicar cualquier cambio que lleve implícito la adjudicación por parte de la AEMPS de un nuevo código nacional.
ANEXO 3. Ejemplo de notificación de modificaciones de la autorización de comercialización de medicamentos autorizados por procedimiento centralizado en RAEVET II. En apoyo de esta notificación se adjuntará una secuencia VNeeS con los cambios autorizados por la CE y completar unos campos predeterminados en la citada pestaña de RAEVET II
NOTA: Realizar un envío por forma farmacéutica y concentración (EU/2/16/XXX/001). CAMPO DE TEXTO LIBRE A COMPLETAR EN RAEVET: Medicamento y breve descripción de la variación (por ejemplo: Nueva indicación, cambio del código ATCvet, cambio de titular, cambio del representante local, etc).
«Con fecha (día) de (mes) de (año) el titular (Titular de la Autorización) ha recibido la Decisión de la CE para la modificación de (motivo de la modificación) para el/los medicamento(s) (Nombre del medicamento).
En España dicha modificación afecta al (los) siguiente (s) formato (s) de dicho(s) medicamento(s):
- Formato 1 del medicamento / Nº de Registro Europeo / C.N.
ANEXO 4. Instrucciones para los TAC y Representantes del titular (locales) en lo relativo a los permisos de inclusión de datos de RAEVET II.
La inclusión de datos en RAEVET II debe ser realizada por el TAC empleando medios propios o autorizando a un tercero.
Puede encontrar la información detallada sobre cómo realizar esta solicitud en la web de la AEMPS, sección Sede Electrónica.
*Modificación de 10 de octubre de 2016, se ha modificado lo siguiente:
PÁGINA 1
Se ha modificado el título
Se ha modificado la entradilla
Se ha eliminado información del primer párrafo
Se ha modificado el segundo y tercer párrafo
Se ha eliminado la información recogida en el cuarto y quinto párrafo
PÁGINA 2
Se ha modificado la s ección 1.1. «Envío de la solicitud»
PÁGINA 3
Se ha modificado la sección 1.2. “Notificación de la AEMPS”
Se ha eliminado la sección 2.2. “Transmisión de la información a la DGCSF”
PÁGINA 4
Se ha modificado el ejemplo de envío del anexo 1. “Modelo de secuencia VNeeS para realizar envío del formulario a través de RAEVET II”
PÁGINA 5
Se ha modificado el anexo 2. “Relación de modificaciones que deben ser notificadas a la AEMPS”
PÁGINA 6
Se ha modificado el anexo 3. “Ejemplo de notificación de modificaciones de la autorización de comercialización de medicamentos autorizados por procedimiento centralizado en RAEVET II.”
PÁGINA 7
Se han modificado las referencias.
Si desea localizar información relacionada con el contenido de esta página, utilice el buscador

