Última actualización: 3/10/2017
Puede consultar esta nota en formato pdfAmpliación de la Nota Informativa con Referencia: SG, 4/2017 Fecha de publicación: 31 de julio de 2017
Fecha de publicación: 3 de octubre de 2017 Categoría: INDUSTRIA, MEDICAMENTOS DE USO HUMANO Referencia: SG, 7/2017
Puesta en marcha de las novedades en el envío y carga de las propuestas de los textos con la información del medicamento y las traducciones para su revisión durante la fase nacional de los procedimientos de solicitud de autorización de comercialización y procedimientos de modificación posteriores.
La AEMPS ha finalizado la adaptación de sus aplicaciones para la puesta en marcha de las novedades en el envío y carga de las propuestas de textos con la información del medicamento y las traducciones para su revisión durante la fase nacional de los procedimientos europeos
La AEMPS decidió eliminar la obligatoriedad del envío de la secuencia de textos propuestos (secuencia 9xxx en procedimientos europeos y secuencia correlativa en registros nacionales), incluyendo también la novedad de la generación automática por parte de la AEMPS de la secuencia 8xxx. Esta propuesta permitirá evitar las tareas reiterativas que suponían hasta ahora el envío de las secuencias conteniendo los textos propuestos y la inclusión posterior de los mismos a través de la herramienta de fraccionamiento.
Para una correcta automatización de las cargas, las propuestas de textos y traducciones (cuando proceda) deberán tramitarse como se describe a continuación:
- SOLICITUDES RELATIVAS A MEDICAMENTOS AUTORIZADOS POR PROCEDIMIENTO DESCENTRALIZADO Y RECONOCIMIENTO MUTUO (Nuevos Registros, Variaciones MRP/ DCP, incluyendo Notificaciones Articulo 61(3) y Revalidaciones Quinquenales MRP/DCPEn estos casos, las propuestas de textos (traducciones), se cargarán en la herramienta de fraccionamiento
En el caso de solicitudes de Medicamentos Autorizados Por Procedimiento Descentralizado Y Reconocimiento Mutuo (Nuevos Registros, Variaciones, incluyendo Notificaciones Articulo 61(3) y Revalidaciones Quinquenales se ha habilitado la opción de la presentación a través de una nueva pestaña denominada (“Otra Documentación”) de los siguientes documentos
(VER ANEXO I)
- Propuesta de traducciones de ficha técnica y prospecto.
- Propuesta de traducción del etiquetado en Word.
- Propuesta de maquetas de etiquetado y prospecto.
- Declaración acreditativa de la fidelidad de la traducción.
- Certificado Braille firmado.
- Textos finales del procedimiento en inglés.
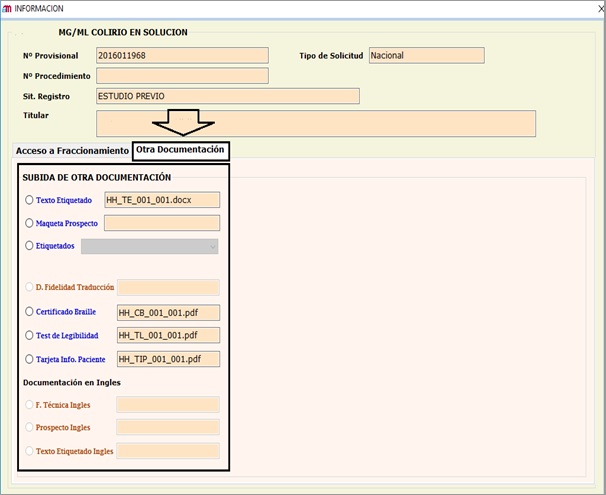
- SOLICITUDES RELATIVAS A MEDICAMENTOS AUTORIZADOS POR PROCEDIMIENTO NACIONAL Y SUS POSTERIORES MODIFICACIONESPara estos procedimientos, igualmente se ha habilitado la opción de la presentación a través de una nueva pestaña denominada (“Otra Documentación”) de los siguientes documentos
(VER ANEXO II)
- Propuesta de ficha técnica y prospecto.
- Propuesta del etiquetado en Word.
- Propuesta de maquetas de etiquetado y prospecto.
- Certificado Braille firmado.
- Test de legibilidad.
ANEXO I
Solicitudes relativas a medicamentos autorizados por Procedimiento Descentralizado y Reconocimiento Mutuo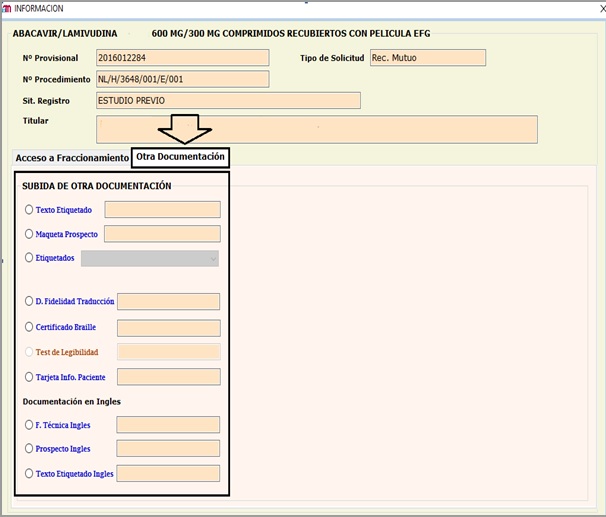
ANEXO II
Solicitudes relativas a medicamentos autorizados por Procedimiento Nacional y sus posteriores modificaciones