Los productos del Anexo XVI deben cumplir con el Reglamento 2017/745 y del Real Decreto 192/2023, así como, con las especificaciones comunes adoptadas para estos productos que se recogen en el Reglamento de Ejecución 2022/2346.
Los productos del Anexo XVI deben cumplir con la legislación de productos sanitarios una vez que les resulte de aplicación las especificaciones comunes adoptadas para estos productos que se recogen en el Reglamento de Ejecución (UE) 2022/2346 de la Comisión de 1 de diciembre de 2022 por el que se establecen especificaciones comunes para los grupos de productos sin finalidad médica prevista enumerados en el anexo XVI del Reglamento (UE) 2017/745 del Parlamento Europeo y del Consejo, sobre los productos sanitarios.
Las especificaciones comunes son de obligado cumplimiento para los fabricantes de productos del Anexo XVI. Estas especificaciones recogen los requisitos relativos a la gestión de riesgos que se han establecido de forma específica para estos productos que no tienen una finalidad médica e incluyen tanto requisitos horizontales para todos los productos del Anexo XVI, así como, requisitos específicos para cada uno de los grupos.
Las especificaciones comunes entraron en aplicación el 22 de junio de 2023. Sin embargo, se han establecido una serie de periodos transitorios a los que pueden acogerse este tipo de productos.
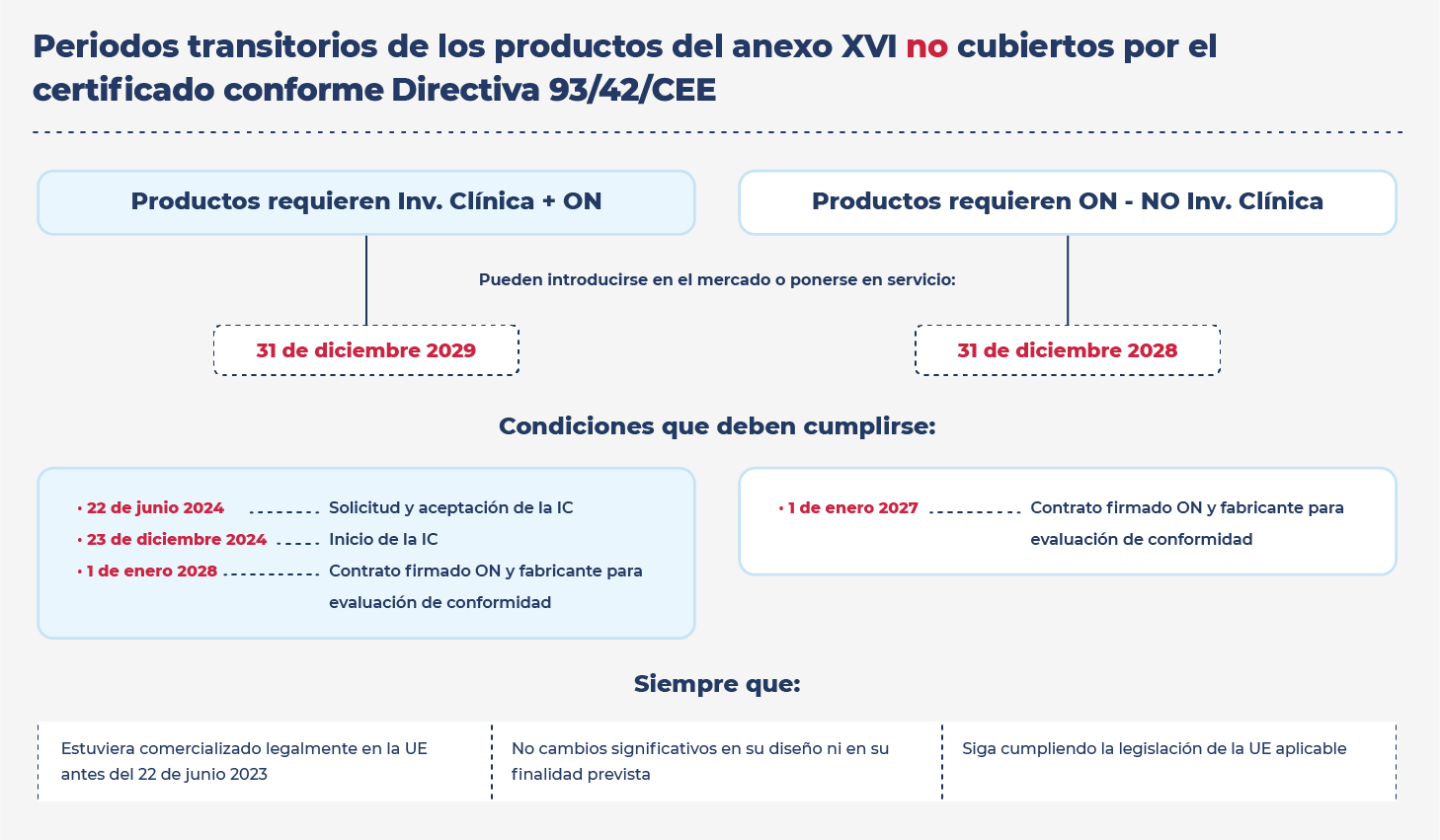
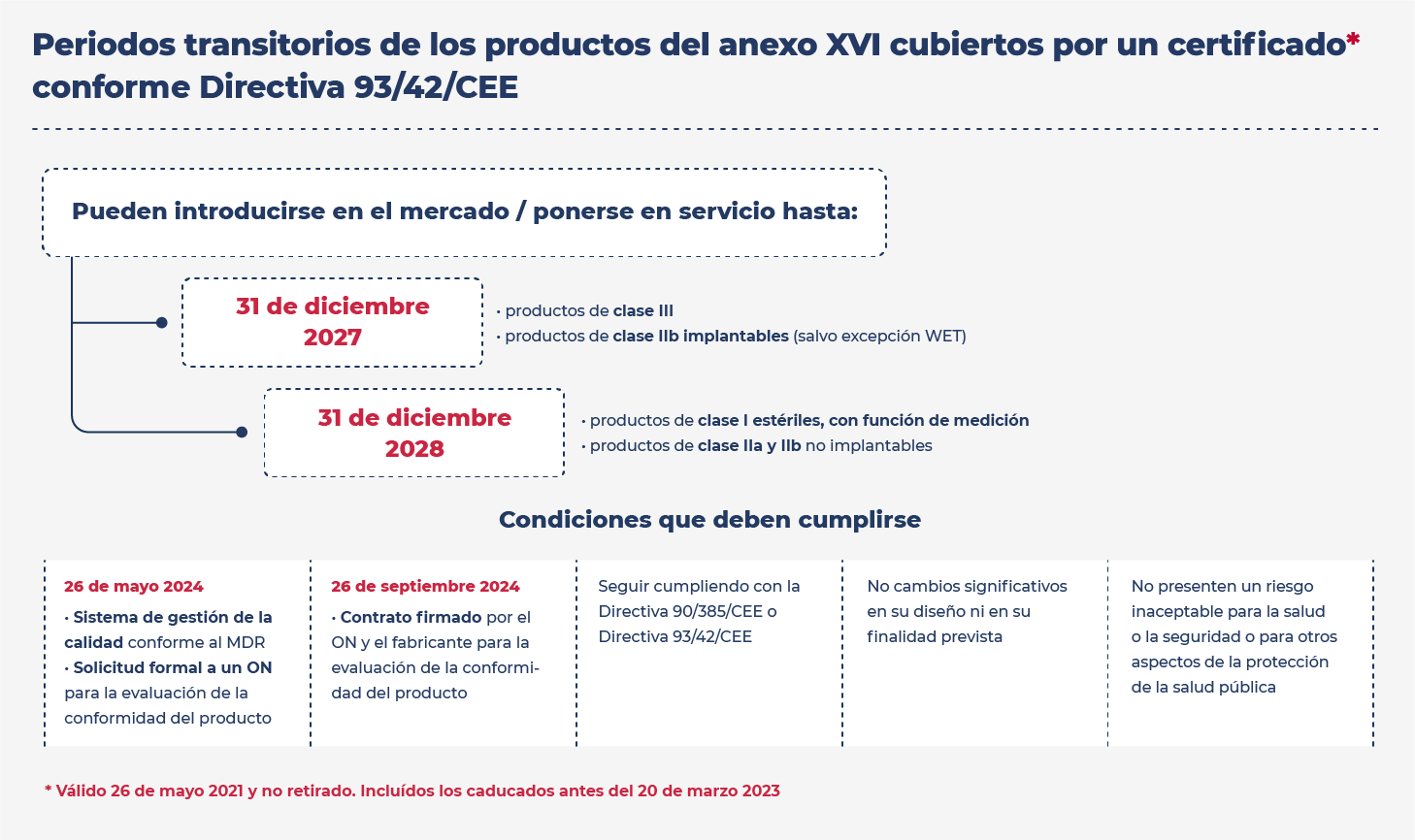
Con el fin de facilitar la aplicación de los periodos transitorios para los productos del Anexo XVI, en el seno de la Comisión se ha elaborado un documento de preguntas y respuestas sobre las disposiciones transitorias para los productos sin finalidad médica recogidos en el Anexo XVI.
Los productos del Anexo XVI que sean introducidos en el mercado o comercializados de acuerdo con el Reglamento 2017/745, deben estar provistos del marcado CE, distintivo que declara la conformidad del producto con los requisitos de seguridad, eficacia y calidad establecidos en la legislación y que debe figurar en el etiquetado y en las instrucciones de uso del producto.
Para la colocación del marcado CE, el fabricante debe seguir uno de los procedimientos de evaluación de la conformidad recogidos en el artículo 52 del Reglamento 2017/745, en función de la clasificación del producto.
Los fabricantes de los productos del Anexo XVI deben llevar a cabo una evaluación clínica, con arreglo al artículo 61 del Reglamento y a la parte A del anexo XIV, para demostrar la conformidad de su producto con los requisitos generales de seguridad y funcionamiento, así como, para evaluar los efectos secundarios y la aceptabilidad del beneficio-riesgo.
En el caso de estos productos, el requisito de demostrar un beneficio clínico debe entenderse como el requisito de demostrar el funcionamiento del producto.
La evaluación clínica debe basarse en los datos pertinentes sobre seguridad, incluidos los datos del seguimiento poscomercialización, del seguimiento clínico poscomercialización específico y, en su caso, de la investigación clínica específica.
Por otra parte, para estos productos se realizarán investigaciones clínicas, a no ser que esté debidamente justificado basarse en los datos clínicos existentes de un producto sanitario análogo. Dado que, de forma general, no es posible demostrar la equivalencia entre un producto sanitario y un producto del anexo XVI, cuando todos los resultados disponibles de las investigaciones clínicas se refieran únicamente a los productos sanitarios, deberán llevarse a cabo investigaciones clínicas de los productos del Anexo XVI.
Los productos del Anexo XVI deben ir acompañados de la información necesaria para identificar al producto y su fabricante, así como, toda la información pertinente sobre su seguridad y su funcionamiento. Esta información podrá figurar en el propio producto, en el embalaje o en las instrucciones de uso y, si el fabricante tiene un sitio web, estará disponible en el mismo.
Su etiquetado y sus instrucciones de uso deben incluir todos los datos obligatorios que se incluyen en el capítulo 23.2 y 23.4 del Anexo I del Reglamento 2017/745.
Además, en el Reglamento de Ejecución (UE) 2022/2346 de las especificaciones comunes se establece la obligación al fabricante de proporcionar información adicional sobre seguridad, debiendo ser incluida también en el etiquetado y en las instrucciones de uso. Concretamente, en su Anexo I se establecen los datos obligatorios que deben incluir todos los productos del Anexo XVI y en el resto de sus Anexos se establece la información específica a proporcionar según el tipo de producto.
En este sentido, todos los productos del Anexo XVI deberán llevar en su etiqueta las palabras “sin finalidad médica prevista” seguidas de una descripción de esta finalidad no médica. Además, si es posible, los fabricantes especificarán en la etiqueta lo siguiente:
- Información relativa a la categoría de usuarios y consumidores a los que va dirigido.
- Funcionamiento previsto del producto.
- Riesgos derivados de la utilización del producto.
Adicionalmente a esta información que se proporciona en el etiquetado y en las instrucciones de uso del producto, para los productos del Anexo XVI que sean de uso por profesional, deben incluir en las instrucciones de uso un Anexo redactado de forma comprensible para profanos y en un formato que facilite su transmisión a los consumidores que deberá contener, entre otras, la información relativa al funcionamiento del producto, sus riesgos y la forma en la que pueden comunicarse posibles efectos secundarios.
Los productos que se comercialicen en España, deben incluir toda esta información, al menos en castellano.