Última actualización: 11/11/2009
Puede consultar esta información en formato pdf
BOLETÍN DE FARMACOVIGILANCIA VETERINARIA
Madrid, 11 de noviembre de 2009
INTRODUCCIÓN
Éste es el tercer boletín que recoge las actividades de Farmacovigilancia Veterinaria llevadas a cabo por la Subdirección General de Medicamentos Veterinarios de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Su objetivo es informar sobre las actividades de farmacovigilancia que la AEMPS ha llevado a cabo durante el año 2008, para mejorar con ello la comunicación entre todos los implicados en general y especialmente con los veterinarios, sobre la vigilancia continua de la eficacia y seguridad de los medicamentos veterinarios.
Es una exigencia de la actual legislación en el ámbito de los medicamentos veterinarios la instauración por parte de las autoridades competentes de los Estados Miembro de la Unión Europea (UE) de Sistemas de Farmacovigilancia Veterinaria. Estos sistemas tienen como fin asegurar que el balance Beneficio / Riesgo que conlleva el uso de los medicamentos veterinarios se mantiene dentro de los márgenes conocidos en el momento en que se otorgan las autorizaciones de comercialización de los medicamentos, que no existen riesgos desconocidos y, si esta situación se modificara, poder prevenir riesgos inaceptables para la salud pública, la sanidad animal y el medio ambiente. En otras palabras, hacer un seguimiento continuo durante la comercialización de los medicamentos en las diferentes condiciones reales de uso de los medicamentos, situación que es imposible abordar en las fases del registro de los medicamentos.
Para el buen funcionamiento de un sistema de farmacovigilancia, la participación activa de los profesionales sanitarios es fundamental ya que cuentan con los conocimientos técnicos necesarios y se encuentran próximos a los animales o a las personas que puedan presentar los problemas.
NOTIFICACIONES INDIVIDUALES DE SOSPECHAS DE REACCIONES ADVERSAS (SARs)
La notificación (comunicación) de una SAR es obligatoria tanto para los profesionales sanitarios como para los laboratorios propietarios de los medicamentos. Para armonizar estas notificaciones a nivel de la UE, la Agencia Europea de Medicamentos (EMEA) elaboró dos formularios, uno de uso exclusivo por profesionales sanitarios y otro para los laboratorios farmacéuticos. La AEMPS los ha editado en papel (el de uso exclusivo por profesionales sanitarios es la conocida como Tarjeta Verde ya preparada para su envío a la Agencia y ser franqueada en destino), ambos se encuentran en la página Web de la Agencia y se han incorporado a la Base de datos de Farmacovigilancia Veterinaria de acceso a través de Internet ( “VIGÍA-VET” ), a la que tienen acceso libre tanto los laboratorios titulares como los profesionales sanitarios.
En el año 2008 se notificaron individualmente a la AEMPS 462 SARs ocurridas en España, 1478 SARs notificadas individualmente ocurridas en terceros países a la UE y 2106 SARs si contabilizamos también las SARs notificadas electrónicamente en el listado de los Informes Periódicos de Seguridad (IPSs). Es importante constatar que ambos datos de SARs, tanto las ocurridas en España como en países terceros, son superiores al de los años 2007 (373 en España y 1421 en otros países) y 2006 (251 en España y 676 en otros países).
Las SARs incluían como principales medicamentos sospechosos de haberlas causado tanto productos autorizados por procedimiento Nacional, incluyendo el Reconocimiento Mutuo y Descentralizado, como Centralizado.
Durante 2008 se recibieron 434 SARs en personas, que tuvieron lugar tanto en España como en otros países (mayoritariamente terceros países fuera de la UE).
De las reacciones notificadas individualmente ocurridas en España, se han enviado a la base de datos Eudravigilance 72. Se trata únicamente de SARs correspondientes a casos graves de medicamentos centralizados. El envío a dicha base de datos de la totalidad de SARS ocurridas en España se hará electrónicamente y de manera automática cuando concluyan los trabajos de compatibilización de las bases de datos Eudravigilance y VIGÍA-VET.
Las SARs responden a problemas de falta de eficacia, de seguridad en los animales a los que se administraron los medicamentos, reacciones adversas en las personas que manipulaban los productos así como problemas con Residuos superiores a los Límites Máximos admitidos (insuficiencia de tiempos de espera). También, se notificó en un Informe Periódico de Seguridad (IPS) hubo una SAR correspondiente a problema medio ambiental. En la inmensa mayoría de los casos notificados, las reacciones fueron graves y, con frecuencia, tuvieron un desenlace fatal, lo cual no es extraño dado que la obligación de la notificación individual atañe preferentemente a las reacciones adversas graves.
En relación con la distribución de SARs por especie animal afectada, se mantiene la pauta de años anteriores, correspondiendo el mayor número de SARs a animales de compañía, con 1155 informes. Gradualmente aumenta también el número de casos en especies productoras de alimentos de consumo humano pudiendo citar en estas 62 en porcino, 101 en bovino y 156 en ovino. Indicar también que ha habido notificaciones en otras especies animales con poca casuística hasta el momento, como: conejos, otras aves, hurones y otros mamíferos. Merece especial atención el incremento notable de SARs ocurridas en ovino, fenómeno que se asocia en buena medida a las notificaciones correspondientes a vacunas de Lengua Azul.
Por el tipo de medicamento implicado en las SARs las mayores incidencias (número de SARs) correspondieron a los siguientes grupos: ectoparasiticidas 679, vacunas 365, AINES 294, antimicrobianos 198 y agentes neurológicos 149 (fundamentalmente anestésicos).
En cuanto al origen de las notificaciones, durante 2008 se ha incrementado de manera importante el número de SARs notificadas por profesionales sanitarios, habiendo recibido por esta vía 88 SARs, algo más de un 19%. En años anteriores eran los laboratorios titulares casi los únicos notificadores. Se pone de manifiesto que, aunque sea a ritmo lento, cada vez son más los profesionales sanitarios que inician su participación en nuestro sistema, y que la promoción que se lleva a cabo directamente a los veterinarios es fructífera. Además, minoritariamente se han recibido SARs de otros notificadores, como propietarios de animales y ganaderos. No se han recibido SARs de profesionales sanitarios que no fueran veterinarios.
En cualquier caso, el número de SARs notificadas a la AEMPS ocurridas en España durante 2008, 462, sigue considerándose bajo aunque se ha incrementado comparándolo con 2007 y 2006. Continúa aún lejos de los índices de notificación que hay en países de nuestro entorno, con poblaciones animales y un número de tratamientos anuales parecidos a los nuestros.
Con respecto al número de SARs notificadas individualmente pero ocurridas fuera de España, 1478 (mayoritariamente en países terceros a la Unión Europea), se ha apreciado un incremento en relación con 2007, año en el que se recibieron 1421. Por tanto también se ha mantenido el incremento de este tipo de SARs comparándolo con años anteriores. Hay que recordar que todas las SARs que se reciben en formato papel son grabadas en VIGÍA-VET, para su posterior análisis informático. Como novedad, en 2008 ha habido varios laboratorios que han enviado este tipo de SARs electrónicamente a la base de datos nacional ó a Eudravigilance.
Los gráficos 1 y 2 muestran de manera más clara los datos anteriormente expuestos.
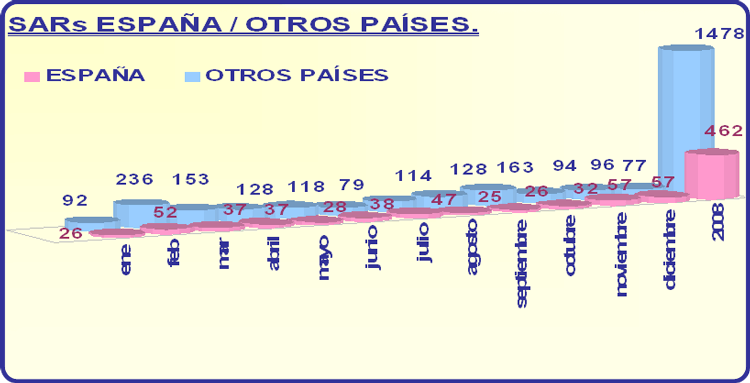
Gráfico 1
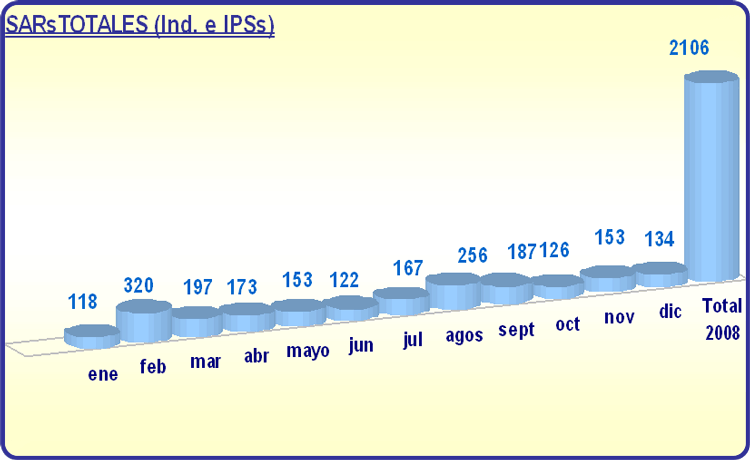
Gráfico 2
El gráfico 3 muestra el número de SARs ocurridas en personas.
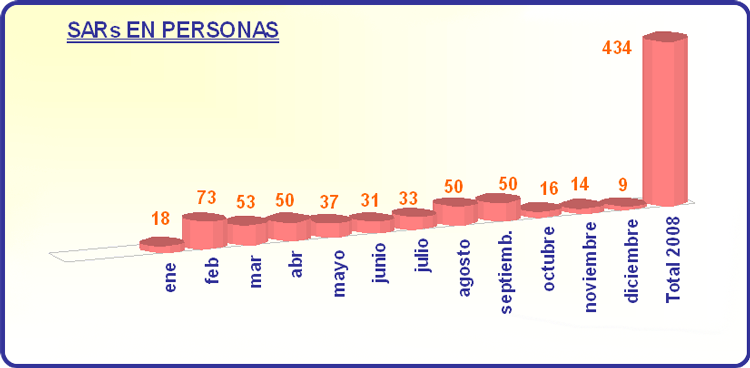
Gráfico 3
Otro punto a destacar es la mayor implementación de Eudravigilance a nivel de la UE, lo que exigirá en 2009 la completa compatibilización entre la misma y la base de datos nacional, VIGÍAVET, así como el envío a la misma de todas las SARs que se reciban en España, y también gestionar y evaluar todas las SARs que los laboratorios envíen directamente a Eudravigilance en lugar de vía papel ó electrónicamente a VIGÍAVET.
INFORMES PERIÓDICOS DE SEGURIDAD (IPSs) y SISTEMAS DE FARMACOVIGILANCIA (SF)
Los titulares son los únicos que tienen la obligación legal de enviar los IPSs a la AEMPS, de acuerdo con unos calendarios fijados por la legislación.
El año 2008 se recibieron 1145 IPS, lo que supone 101 informes más que en 2007. Esto manifiesta el incremento constante e importante que anualmente presenta este tipo de informes. Desde el año 2000 hasta el 2008 el número de IPSs presentados se ha multiplicado más de 20 veces.
En el gráfico 4 se puede valorar la evolución en el número de IPSs recibidos desde la constitución de la AEMPS.
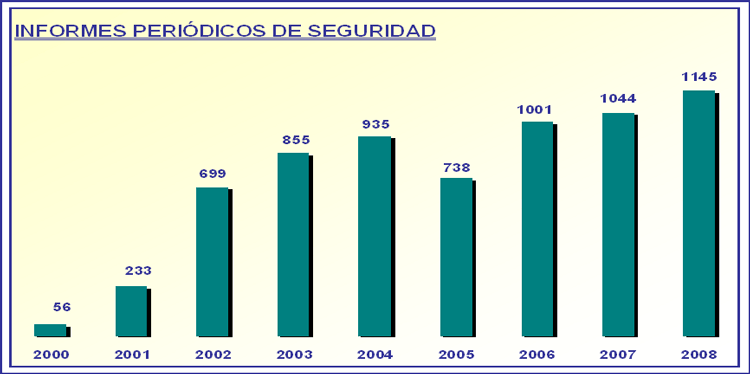
Gráfico 4
En el año 2008 se ha participado con otras seis Agencias reguladoras (Francia, Países Bajos, Irlanda, Dinamarca, Alemania y República Checa), en un programa piloto conocido como “PSUR Worksharing”, plan aprobado por los Jefes de Agencias de la UE, que tiene por objeto por una parte armonizar las fechas de presentación de los IPSs de los productos autorizados que incluyen determinados principios activos en toda la UE y, por otra, distribuir la responsabilidad en la evaluación de los IPSs entre las Agencias reguladoras. Así, para cada una de las moléculas incluidas en el programa, se elige a un país como responsable, que será el encargado de elaborar los informes de evaluación y consensuar las decisiones. Para cada una de las moléculas seleccionadas como participantes del programa existirá por tanto una Agencia que actúa como Estado miembro de Referencia (RMS) y las otras seis Agencias actuarían como Estados miembro concernidos (CMSs).
En el marco de este programa nuestra Agencia ha sido ponente para las siguientes moléculas: Miconazol+Polimixina+Prednisolona, y Cabergolina en el primer semestre del año, y Eritromicina, Kanamicina y Fenilpropanolamina en el segundo semestre. Correspondientes a estas moléculas se han elaborado 16 informes, y como concernidos hemos recibido IPSs de otras 53 moléculas más.
Durante el año 2008, conforme a la línea directriz aprobada por el CVMP en octubre, se han elaborado informes de evaluación (AR) de 99 IPSs, 29 correspondientes a procedimientos de RM y descentralizado, 52 correspondientes a solicitudes de renovación de medicamentos autorizados por procedimiento nacional, o de informes de evaluación de productos específicos presentados al Comité de Seguridad de Medicamentos Veterinarios, 2 informes de un producto autorizado por procedimiento centralizado en el que España es ponente, y 16 informes de IPS pertenecientes al programa de Worksharing.
Se han evaluado además, 6 de los 8 IPSs recibidos correspondientes a medicamentos sometidos a un especial seguimiento en años anteriores.
Como resultado de la evaluación de los IPSs, en siete de ellos se ha concluido que era necesaria la adopción de alguna medida especial, normalmente relativa a modificación de la Ficha Técnica del medicamento afectado. En el resto, la evaluación de los informes ha reflejado un adecuado balance beneficio-riesgo, no siendo necesaria medida adicional alguna.
En relación con los Sistemas de Farmacovigilancia (SF), la legislación de la UE establece que cada solicitud de registro que los laboratorios presenten debe incluir una Descripción detallada del Sistema de Farmacovigilancia que ese laboratorio tiene implantado para el cumplimiento de las obligaciones de farmacovigilancia de ese producto concreto. Esta parte del expediente debe validarse y evaluarse de la misma manera que se lleva a cabo con las correspondientes a la calidad, la eficacia y la seguridad.
En el año 2008 se recibieron para su evaluación 66 Sistemas de Farmacovigilancia. De 16 de ellos se ha elaborado informe de evaluación, siguiendo la línea directriz comunitaria aprobada en abril de 2007 por el CVMP. Han correspondido 7 a procedimientos de reconocimiento mutuo, 8 a procedimientos descentralizados y 1 a un procedimiento nacional.
En 2009 se incrementará notablemente esta cifra porque todas las solicitudes, incluyendo las puramente nacionales, deben cumplir con este requisito legal una vez ha entrado en vigor el Real Decreto 1246/2008, por el que se regula el procedimiento de autorización, registro y farmacovigilancia de los medicamentos veterinarios fabricados industrialmente.
En el gráfico 5 figura el número de IPSs y Sistemas de Farmacovigilancia recibidos en 2008.
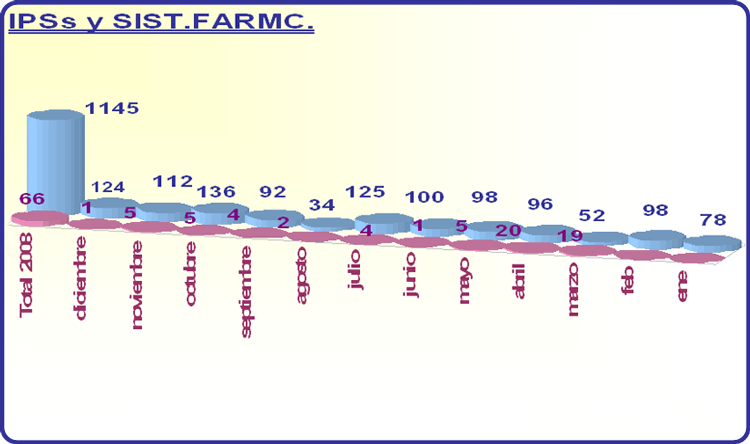
Gráfico 5
PROCEDIMIENTOS CENTRALIZADOS, DESCENTRALIZADOS Y DE RECONOCIMIENTO MUTUO
Como se ha indicado anteriormente, en el año 2008 se han elaborado conforme con la guía directriz vigente 16 Informes de Evaluación de los Sistemas de Farmacovigilancia que entraron en la Unidad en el mismo año, 7 correspondientes a procedimientos de reconocimiento mutuo y 8 a procedimientos descentralizados y 1 a procedimiento nacional.
En cuanto a los IPSs, se han elaborado conforme con la guía directriz 2 Informes de Evaluación correspondientes al segundo y al tercer IPS semestrales de un medicamento centralizado en el que España actúa como ponente, así como 29 de Reconocimiento Mutuo o Descentralizado, en los que España es RMS y 16 del programa de Worksharing.
En 2008 se han elaborado 8 informes de la documentación relativa a farmacovigilancia (evaluación de los últimos IPSs presentados y de las SARs notificadas individualmente) de medicamentos de referencia para los que se han presentado solicitudes de medicamentos genéricos por procedimiento de reconocimiento mutuo en otros países de la UE.
ALERTAS E INFORMACIÓN de SEGURIDAD NO URGENTE (NUIS) POR RAZONES DE FARMACOVIGILANCIA
Durante el año 2008 se han recibido y evaluado 8 notificaciones de NUIS de farmacovigilancia, pero ninguna Alerta Rápida.
COMITÉ DE SEGURIDAD DE MEDICAMENTOS VETERINARIOS (CSMV)
Durante 2008 el CSMV se reunió tres veces.
Las actuaciones más relevantes del Comité fueron:
- Presentación del programa europeo del Worksharing de los IPSs.
- Participación en los trabajos de elaboración del nuevo Volumen 9B que recoge las líneas directrices relativas a la farmacovigilancia veterinaria. Nuestra Agencia ha participado en el grupo de trabajo que EMEA constituyó en 2008 con el objetivo de elaborar este documento.
- Participación en diversas propuestas relativas a la promoción de la farmacovigilancia. En este sentido, con el fin de mejorar la promoción de la farmacovigilancia y tras un acuerdo adoptado por el CSMV en la segunda reunión de 2008, se llevó a cabo una reunión específica en el mes de julio con participación de la industria, el CSMV y la Subdirección General. Actualmente, se están implantando algunas de las nuevas propuestas que se adoptaron en la misma.
- Propuestas de modificación de los textos de algunos medicamentos.
- Evaluación de la línea directriz aprobada en octubre por el CVMP relativa a la elaboración de informes de evaluación de los IPSs.
PROMOCIÓN DE LA FARMACOVIGILANCIA VETERINARIA
La promoción de la Farmacovigilancia Veterinaria sigue siendo un punto estratégico en el seno de la AEMPS, por tratarse de una obligación legal contemplada en las Directivas europeas. Esta prioridad se basa en que los índices de notificación de algunos países aún no son los adecuados (no se está notificando todo lo que realmente ocurre) y, en paralelo, la legislación cada día fundamenta más el control de la seguridad y eficacia de los medicamentos veterinarios en los Sistemas de Farmacovigilancia implantados.
En el Grupo de Farmacovigilancia del CVMP se está primando este tipo de iniciativas, para que se desarrollen de forma armonizada en todos los países las actuaciones en este ámbito. Así por ejemplo, se ha sugerido que se impartan conferencias en las Facultades de Veterinaria, tras valorar positivamente la iniciativa implantada por nuestra agencia.
Para incrementar la promoción del sistema se han presentado ponencias y participado en jornadas informativas en todas las Facultades de Veterinaria de España, salvo en la ubicada en las Islas Canarias. Además, se ha participado en el Congreso de ANEMBE (Asociación Nacional de Especialistas en Medicina Bovina de España) en Salamanca, y en la Reunión de ANAPORC (Asociación de Porcinocultura Científica) de Córdoba. También se participó en la Jornada sobre antimicrobianos en veterinaria, organizada por la AEMPS.
De manera especial se ha llevado a cabo la promoción a los veterinarios en ejercicio clínico, puesto que son uno de los principales colectivos notificadores, participando en distintos cursos organizados por el Consejo General de Colegios de Veterinarios. Como consecuencia, ha crecido el número de veterinarios que han notificado SARs, así como el número de SARs recibidas en 2008.
PARTICIPACIÓN EN REUNIONES INTERNACIONALES
En 2008 se ha participado activamente en las reuniones del Grupo de Trabajo de Farmacovigilancia Veterinaria de la EMEA, del Joint Implementation Group (JIG) de Eudravigilance, del Subgrupo de terminología -VEDDRA- y en las sesiones específicas del Grupo de Trabajo de elaboración del nuevo Volumen 9B.

