El artículo 75 del texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, aprobado por el Real Decreto Legislativo 1/2015, de 24 de julio, establece las bases para un registro de acceso público de laboratorios farmacéuticos con el fin de reforzar las garantías de la cadena farmacéutica, así como las políticas de transparencia del Ministerio de Sanidad.
El objeto del registro es mostrar los datos de los laboratorios farmacéuticos autorizados en España:
- Laboratorios que fabrican o importan medicamentos (laboratorios farmacéuticos fabricantes o importadores).
- Los titulares de las autorizaciones de comercialización de medicamentos que cuentan con instalaciones de almacenamiento para los mismos (laboratorios titulares de autorización de comercialización).
Estos laboratorios son autorizados por la AEMPS en base a los artículos 5 y 37 del Real Decreto 824/2010, de 25 de junio, por el que se regulan los laboratorios farmacéuticos, los fabricantes de principios activos de uso farmacéutico y el comercio exterior de medicamentos y medicamentos en investigación. El Capítulo VI de este real decreto desarrolla el artículo 75 del texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
Tanto la autorización inicial de los laboratorios, como sus modificaciones, se tramitan a través de la aplicación informática LABOFAR, desarrollada por la AEMPS para trámites con la industria farmacéutica; al concluir la tramitación de las mismas, dicha información se incorpora automáticamente al registro de laboratorios, que, de esa manera, se mantiene permanentemente actualizado.
De acuerdo a lo dispuesto en el artículo 10 del Real Decreto 824/2010, de 25 de junio, el contenido de la autorización de laboratorio farmacéutico será el siguiente:
- La autorización recogerá los datos de instalaciones, actividad, formas farmacéuticas y directores técnicos.
- La autorización de laboratorio farmacéutico fabricante o importador se concederá de acuerdo con el estado de los conocimientos científicos y técnicos generalmente aceptados en el momento de la resolución.
- El documento de autorización de laboratorio farmacéutico fabricante o importador se ajustará al formato armonizado, conforme a los procedimientos comunitarios.
- Los formatos de autorización de los laboratorios, en los que se basan los datos publicados en el registro, proceden, por tanto, de los formatos comunitarios publicados por la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés) para los fabricantes y/o importadores de medicamentos y para los distribuidores: Compilation of Union Procedures on Inspections and Exchange of Information.
Además de publicar esta información en el Registro de Laboratorios Farmacéuticos, las autorizaciones y los certificados de normas de correcta fabricación o buenas prácticas de distribución son cargados en la base de datos europea EudraGMDP.
Para ello, las empresas fabricantes, importadoras y distribuidoras de medicamentos y principios activos deben asegurarse de que los detalles relacionados con su organización estén correctamente registrados en la base de datos de la Agencia Europea de Medicamentos (EMA) denominada SPOR, en concreto, en el Servicio de Gestión de Organizaciones (OMS, por sus siglas en inglés). Puede obtenerse más información sobre esta cuestión consultando la sesión informativa celebrada en la AEMPS.
Los laboratorios fabricantes e importadores autorizados incluidos en este registro están sujetos a inspecciones periódicas para supervisar el cumplimiento de las normas de correcta fabricación de la Unión Europea.
¿Qué información está disponible en el registro para los laboratorios farmacéuticos fabricantes/importadores?
El presente registro incluye todos los datos de actividad que los laboratorios tienen recogidos en su autorización, emitida en base a la normativa anteriormente descrita, con la excepción de los datos de carácter personal.
La información recogida de cada laboratorio farmacéutico fabricante/importador es la siguiente:
- Datos administrativos del laboratorio: nombre del titular de la autorización, dirección y datos de contacto.
- Ámbito de la autorización:
- Fabricante de medicamentos (de uso humano/veterinario/en investigación).
- Importador de medicamentos (de uso humano/veterinario/en investigación).
- Titular de autorización de comercialización de medicamentos con instalaciones de almacenamiento (especificando si lo es también de estupefacientes y/o psicótropos), si, además, tiene autorizada la actividad de fabricación o importación.
- Plantas de fabricación: ubicación y tipos de medicamentos y formas farmacéuticas que fabrica y/o controla.
- Certificados de normas de correcta fabricación (NCF) vigentes para cada planta del laboratorio.
¿Cómo se realizan las búsquedas en el registro?
El registro diferencia las siguientes secciones por tipo de laboratorios:
- Laboratorios farmacéuticos fabricantes/importadores de medicamentos. Si el laboratorio también es titular de algún medicamento, se encontrará sólo en esta sección.
- Laboratorios sólo titulares de autorización de comercialización de medicamentos.
En cada sección, la aplicación ofrece un solo campo de búsqueda de los laboratorios por nombre de la empresa. Si no se conoce el nombre exacto, se pueden introducir las primeras letras del mismo para realizar la búsqueda.
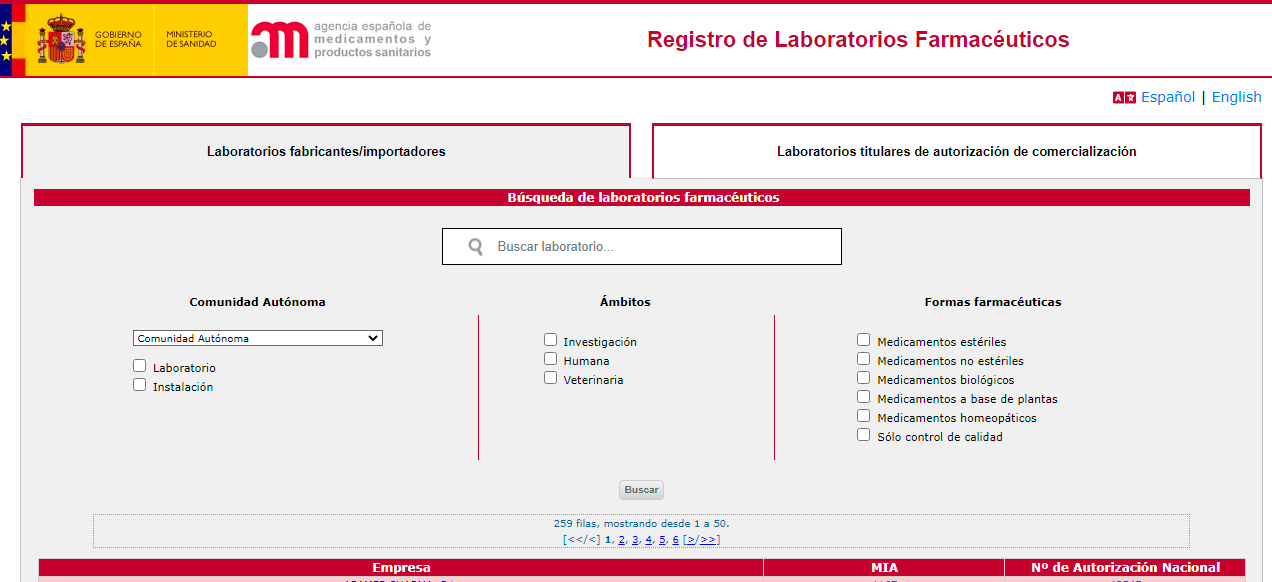
Una vez seleccionado el laboratorio, se accede a sus datos generales.
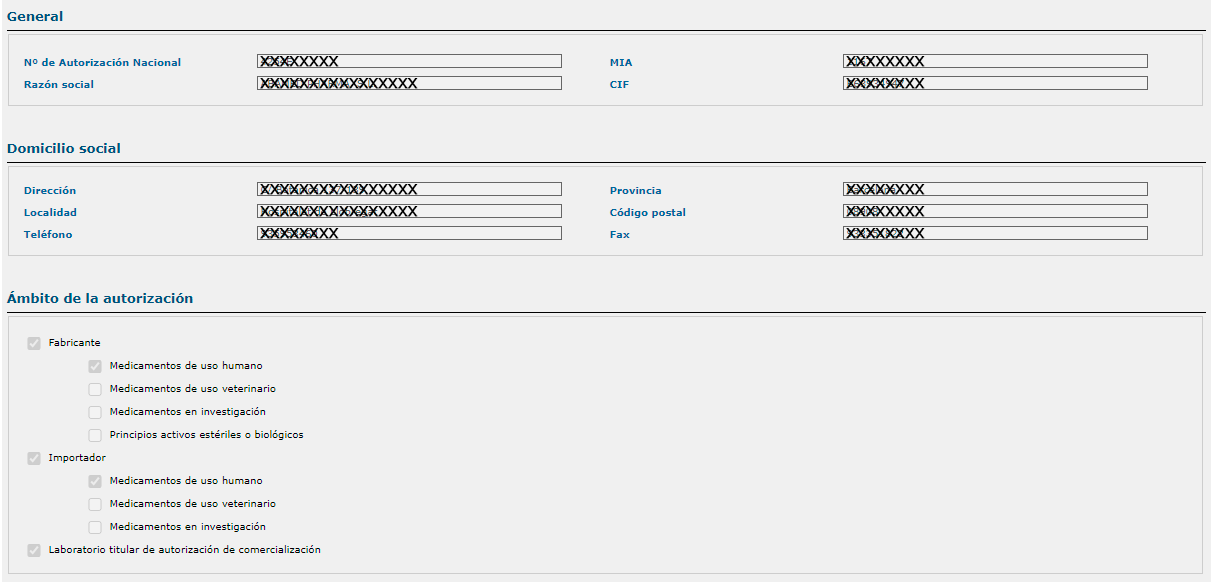
Desde las plantas de fabricación se puede tener acceso a los tipos de medicamentos y formas farmacéuticas que se fabrican en esa instalación, marcando a la derecha «Ver detalle». Para cada forma farmacéutica, se proporciona información sobre si la misma corresponde a un medicamento de uso humano (H), veterinario (V) o en investigación (I).
Asimismo, se ofrece información sobre las fases de fabricación del medicamento en esa instalación (granel, acondicionamiento primario, acondicionamiento secundario, control de calidad o la certificación de lotes).
También puede visualizarse para cada instalación del laboratorio farmacéutico el certificado de NCF de la correspondiente planta.
Los laboratorios que cesan su actividad de forma definitiva son eliminados de este registro, al ser revocadas sus autorizaciones. Sin embargo, sí se mantienen aquellos que, por el motivo que sea, cesan temporalmente su actividad y, por tanto, figura en su registro la leyenda “Autorización suspendida temporalmente”. Una vez levantada la suspensión, vuelven a visualizarse normalmente.
Además de publicar esta información en el Registro de Laboratorios Farmacéuticos, las autorizaciones y los certificados de normas de correcta fabricación o buenas prácticas de distribución son cargados en la base de datos europea EudraGMDP.
Para ello, las empresas fabricantes, importadoras y distribuidoras de medicamentos y principios activos deben asegurarse de que los detalles relacionados con su organización estén correctamente registrados en la base de datos de la Agencia Europea de Medicamentos (EMA) denominada SPOR, en concreto, en el Servicio de Gestión de Organizaciones (OMS, por sus siglas en inglés). Puede obtenerse más información sobre esta cuestión consultando la sesión informativa celebrada en la AEMPS.
Es importante hacer una diferenciación entre los siguientes conceptos:
- Titular de la autorización de comercialización: es la persona física o jurídica responsable de la comercialización del medicamento para el que ha obtenido la preceptiva autorización de comercialización.
- Laboratorio titular de la autorización de comercialización: es la persona física o jurídica responsable de la comercialización del medicamento, para el que ha obtenido la preceptiva autorización de comercialización, y que dispone en España de instalaciones, propias o contratadas, para almacenar y distribuir sus medicamentos.
Teniendo en cuenta esto, cabe la posibilidad de que no todos los titulares de medicamentos se encuentren en este registro dados de alta como laboratorios. Sí se encontrarán, no obstante, en las autorizaciones de comercialización de medicamentos registrados, que incluyen los datos de sus titulares de autorización de comercialización.
Se incluyen en este registro de laboratorios tanto los laboratorios titulares de medicamentos de uso humano como los de medicamentos veterinarios sin hacer distinción en su nombre.
No obstante, sí se indicará si son laboratorios titulares de medicamentos estupefacientes/psicótropos.
Asimismo, los laboratorios titulares de autorización de comercialización de medicamentos de uso humano han de cumplir con las buenas prácticas de distribución de medicamentos, según lo estipulado en el artículo 1.3 del Real Decreto 782/2013, de 11 de octubre, sobre distribución de medicamentos de uso humano y en el Reglamento de Ejecución (UE) 2021/1248 de la Comisión, de 29 de julio de 2021, por lo que respecta a las medidas sobre buenas prácticas de distribución de medicamentos veterinarios, de conformidad con el Reglamento (UE) 2019/6 del Parlamento Europeo y del Consejo.
¿Qué información está disponible para los laboratorios titulares?
Al igual que para los laboratorios fabricantes, el registro incluye todos los datos de actividad que los laboratorios tienen recogidos en su autorización, emitida en base a la normativa anteriormente descrita, con la excepción de los datos de carácter personal.
La información recogida de cada laboratorio sólo titular de autorización de comercialización es la siguiente:
- Datos administrativos del laboratorio: número de autorización, nombre del titular de la autorización, dirección y datos de contacto.
- En el apartado de “Establecimiento”, se puede visualizar el ámbito de la autorización: conservación (almacenamiento), suministro, exportación de medicamentos.
- Instalaciones de almacenamiento de medicamentos, propias o contratadas.
- Si tiene instalaciones propias de almacenamiento, los requisitos especiales de almacenamiento: termolábiles, gases medicinales, radiofármacos, estupefacientes/psicótropos, etc.
- Si es sólo titular de autorización de comercialización de medicamentos veterinarios, se indicará este hecho en la sección de “Aclaraciones/restricciones”.
- Certificados de buenas prácticas de distribución de los establecimientos propios del laboratorio.
¿Cómo se realizan las búsquedas en el registro?
El registro diferencia las siguientes secciones por tipo de laboratorios:
- Laboratorios farmacéuticos fabricantes/importadores de medicamentos. Si, además, el laboratorio también es titular de algún medicamento, se encontrará sólo en esta sección.
- Laboratorios sólo titulares de autorización de comercialización.
En cada sección, la aplicación ofrece un solo campo de búsqueda de los laboratorios por nombre de la empresa. Si no se conoce el nombre exacto, se pueden introducir las primeras letras del mismo para realizar la búsqueda.
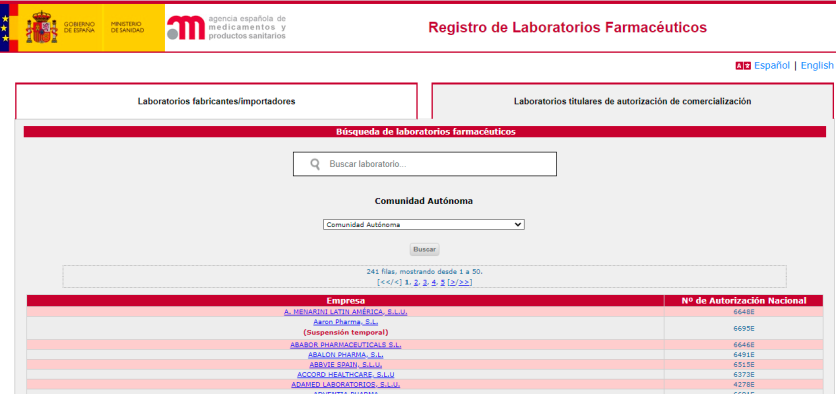
Una vez seleccionado el laboratorio, se accede a los datos generales del mismo.
Sobre los laboratorios titulares, se ofrece información sobre los tipos de medicamentos con los que trabaja, las actividades autorizadas al laboratorio y los requisitos adicionales de conservación de los medicamentos que se almacenen en esa instalación.
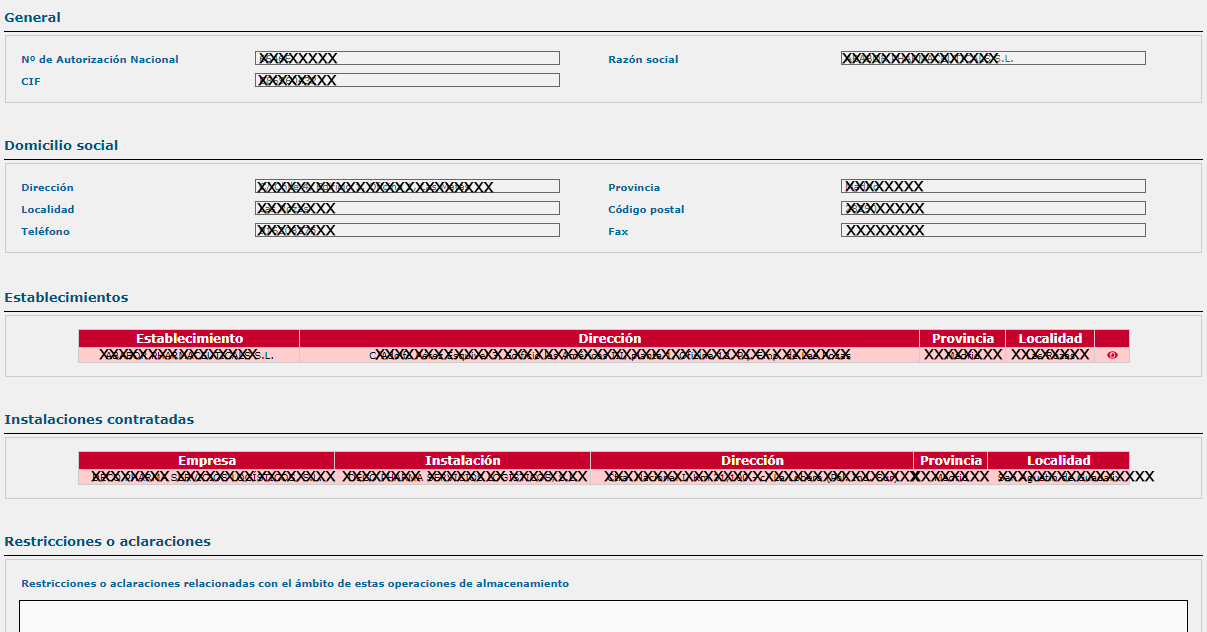
Los laboratorios que cesan su actividad de forma definitiva son eliminados de este registro, al ser revocadas sus autorizaciones. Sin embargo, sí se mantienen aquellos que por el motivo que sea, cesan temporalmente su actividad y, por tanto, figura en su registro la leyenda “Autorización suspendida temporalmente”. Una vez levantada la suspensión, vuelven a visualizarse normalmente.

