Última actualización: 27/6/2017
Puede consultar esta nota en formato pdf
Fecha de publicación: 27 de junio de 2017
Categoría: INDUSTRIA, MEDICAMENTOS VETERINARIOS
Referencia: MVET, 9/2017
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha implementado una iniciativa para que, una vez adoptada la Decisión de la Comisión Europea (CE) por la que se concede la autorización de comercialización para un medicamento veterinario autorizado por procedimiento centralizado, el Titular de la Autorización de Comercialización (TAC) pueda presentar telemáticamente la «Solicitud de Código Nacional para la Comercialización en España» a través de RAEVET II.
La AEMPS ha venido implantando una serie de mejoras con objeto de agilizar la tramitación de las autorizaciones y modificaciones de comercialización de los medicamentos. Estas mejoras se quieren extender ahora también a los medicamentos que se tramitan por la EMA a través del procedimiento centralizado, cuya autorización culmina con la preceptiva Decisión de la CE, y que implica que la AEMPS asigne el código nacional para cada formato y lo notifique al TAC.
La participación del TAC en la inclusión de la información de registro en RAEVET II, a la cual se adjuntará la solicitud de código nacional (CN), contribuye a disminuir la carga de trabajo administrativo y permite a su vez integrar la documentación en los nuevos sistemas de notificación automatizada de la AEMPS, mejorando así todo el proceso.
El TAC también se podrá acoger a este nuevo proceso de inclusión de información en RAEVET II, con posterioridad a la Decisión de la CE, para cualquier otro formato ya autorizado que pretenda comercializar.
En consecuencia, los TAC de medicamentos que se tramiten por procedimiento centralizado deberán ajustarse a lo siguiente:
-
AUTORIZACION INICIAL
1.1 Envío de la solicitud
Dictada la Decisión de la CE por la que se autoriza el medicamento , el solicitante presentará telemáticamente la «Solicitud de Código Nacional para la Comercialización en España» a través de RAEVET II. Para ello, se debe realizar la correspondiente solicitud a través de la pestaña “Comunicación de Autorizaciones de Medicamentos Centralizados (petición CN)” (V/16), disponible en RAEVET II, indicando en los campos correspondientes de la solicitud el número de procedimiento global asignado por la EMA “EMA/C/V/XXXXXX, el del medicamento (EU/2/XX/XXX) y el/los formato/s a comercializar (EU/2/XX/XXX/001-00X). Es imprescindible rellenar, en las pestañas correspondientes y habilitadas a tal efecto en la aplicación de RAEVET II, cada uno de los formatos que se van a solicitar. Es muy importante que el orden de inclusión de formatos siga el mismo orden de aparición que en el eAF.
En la secuencia se incluirá un formulario de solicitud eAF por cada concentración, forma farmacéutica o especie de destino de cada nueva autorización del medicamento centralizado que se pretenda comercializar en España. Asegúrese de utilizar la versión vigente en el momento de la solicitud ( http://esubmission.ema.europa.eu/eaf/) disponible para su descarga en la web de Eudralex o en esubmission, siendo imprescindible rellenar los apartados marcados como obligatorios para los medicamentos centralizados. En el caso de, por ejemplo, no estar disponible el código ATCvet, se indicaría el facilitado provisionalmente. Se recomienda encarecidamente remitir un solo eAF por cada forma farmacéutica, concentración o especie de destino, que incluya, en la sección 2.2., los formatos asociados a esa forma farmacéutica, concentración o especie de destino que tengan intención de comercializar.
Por ejemplo: El TAC solicita el CN para los siguientes formatos:
El TAC enviará la siguiente documentación a través de 3 envíos (1 por cada eAF):Nº DE REGISTRO EUROPEO DEL MEDICAMENTO NOMBRE DEL MEDICAMENTO FORMATOS EU/2/XX/XXXX Denominación 100 mg/ml solución inyectable para bovino EU/2/XX/XXXX/001 EU/2/XX/XXXX Denominación 100 mg/ml solución inyectable para porcino EU/2/XX/XXXX/002 EU/2/XX/XXXX Denominación 100 mg/ml solución inyectable para equino EU/2/XX/XXXX/005 EU/2/XX/XXXX Denominación 200 mg/ml solución inyectable para bovino EU/2/XX/XXXX/007 EU/2/XX/XXXX Denominación 200 mg/ml solución inyectable para porcino EU/2/XX/XXXX/008 EU/2/XX/XXXX Denominación 100 mg/ml comprimidos masticables. EU/2/XX/XXXX/010
La AEMPS generará en total 3 Números de Registro y 6 CNs:Cover
LetterDecisión Comisión Nº envíos Nº eAFs Nº Formatos en cada eAF Doc Adicional 1
1
1
eAF1
EU/2/XX/XXXX/001
1
EU/2/XX/XXXX/002
EU/2/XX/XXXX/005
1
1
1
eAF2
EU/2/XX/XXXX/007
1
EU/2/XX/XXXX/008
1
1
1
eAF3
EU/2/XX/XXXX/010
1
TOTAL
3
3
3
3
6
3
Nº Registro AEMPS Nº CN NR AEMPS1 EU/2/XX/XXXX/001 EU/2/XX/XXXX/002 EU/2/XX/XXXX/005 NR AEMPS2 EU/2/XX/XXXX/007 EU/2/XX/XXXX/008 NR AEMPS3 EU/2/XX/XXXX/0010 TOTAL 3 6 Los eAF se incluirán en la carpeta P1/1a-admin-info/
Con el envío de este formulario se adjuntará la siguiente documentación:
- Fotocopia, en español, de la Decisión de la CE por la que se autoriza el medicamento.
- Copia de la versión vigente de los datos administrativos europeos (obtenida del expediente eCTD del dossier europeo de registros para este medicamento).
- los eAF debidamente cumplimentado, bloqueado y guardado en formato digital.
Esta documentación se presentará en paralelo al envío de la/las solicitud/es en Raevet II (COMUNICACIÓN DE AUTORIZACIONES DE MEDICAMENTOS CENTRALIZADOS (Petición CN) (V-16)), y se estructurará como una secuencia VNeeS, incluyendo toda la documentación dentro de la Parte 1. Como anexo 1 a esta instrucción, se incluye un modelo de secuencia VNeeS, para realizar dicho envío.
- Para cualquier duda sobre la carga en RAEVET II se debe dirigir al correo electrónico “edossier@aemps.es”.
-
1.2. Notificación de la AEMPS
Si se ha seguido el proceso descrito, la AEMPS notificará al TAC mediante la "Comunicación del Código Nacional para la comercialización en España".
La AEMPS ha trabajado e implementado el desarrollo informático necesario para que se reciba dicha notificación por vía electrónica, mediante un mensaje de aviso a la dirección de correo electrónico que el solicitante indique en los apartados 2.4.1., 2.4.2. del/de los formulario(s) eAF presentado/s (Titular, Persona designada por él). Dicha comunicación de resolución incluirá el código nacional asignado al formato para el que se solicitó. Al no haber punto para indicar Representante Local en los formularios de solicitud, éste será indicado en el escrito de presentación (“cover letter”) y será notificado también por vía electrónica.
1.3. Comunicación de comercialización efectiva
De acuerdo con lo establecido en el artículo 27 del RD 1246/2008, el solicitante debe comunicar de forma expresa a la AEMPS la fecha de comercialización efectiva de cada medicamento, como mínimo quince días antes de efectuarse dicha comercialización. Para señalar la fecha de comercialización efectiva se empleará la aplicación "Aplicación informática de Comercialización de Medicamentos Veterinarios".
-
MODIFICACIONES DE AUTORIZACION
2.1. Notificación de la modificación
Para aquellas modificaciones de los medicamentos centralizados que deban ser notificadas a la AEMPS, tal como se indica en el anexo 2 de la presente instrucción, una vez obtenida la autorización de la autoridad competente, cuando proceda, el solicitante utilizará la pestaña de RAEVET II, habilitada para enviar estas notificaciones (SOLICITUD/MODIFICACIONES CENTRALIZADOS (V-09)).
En el anexo 3 se muestra un ejemplo de la información a introducir por cada formato, a la cual se adjuntará un envío de una secuencia VNeeS que incluya la documentación pertinente en cada caso (Copia de la Decisión de la CE, etc.).
Tanto para las Solicitudes de “Autorización Inicial” como para las “Modificaciones de Autorización” encontrará un manual RAEVET II – REGISTRO COMÚN AEMPS “Petición de Código Nacional & Comunicación de Modificaciones de Medicamentos Autorizados por Procedimiento Centralizado” en la sede electrónica de la AEMPS y en misma solicitud de RAEVET II.
Para cualquier duda, se deberá dirigir a la dirección de correo electrónico “edossier@aemps.es”.
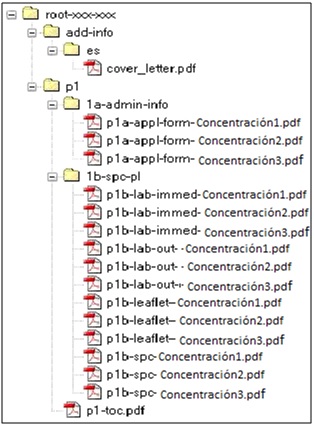
ANEXO 1. Modelo de secuencia VNEES como ejemplo de un envío para 3 concentraciones de una forma farmacéutica:
ANEXO 2. Relación de modificaciones que deben ser notificadas a la AEMPS:
- Cambio del TAC o de su dirección.
- Cambio de representante local o de su dirección.
- Cambio del nombre del medicamento.
- Cambio, supresión o nueva indicación terapéutica.
- Cambio, supresión o nueva especie de destino.
- Cambio, supresión o nueva forma farmacéutica.
- Cambio del tiempo de espera.
- Cambio del periodo de validez.
- Cambio en el grupo terapéutico (ATCvet).
- Otros cambios relevantes en la ficha técnica (FT).
- Comunicación de la anulación de un medicamento.
- Comunicación de la suspensión temporal de comercialización.
- Adición de nuevos formatos (nuevos CN)
Es muy importante que el orden de inclusión de formatos en la aplicación RAEVET II siga el mismo orden de aparición que en el eAF.
En el caso de la comunicación de la anulación o suspensión de comercialización de un código nacional, el TAC debe además cumplimentar los apartados correspondientes en la aplicación «Notificaciones sobre comercialización de medicamentos» (*).
Asimismo, se deberá comunicar cualquier cambio que lleve implícita la adjudicación por parte de la AEMPS de un nuevo código nacional.
Para tramitar un nuevo formato de un medicamento ya comercializado en España se deberá presentar en RAEVET II una nueva solicitud de código nacional y seguir el mismo proceso que se especifica en este documento.
ANEXO 3. Ejemplo de notificación de modificaciones de la autorización de comercialización de medicamentos autorizados por procedimiento centralizado en RAEVET II.
NOTA: Realizar un envío por forma farmacéutica, concentración o especie de destino (EU/2/XX/XXX/001). CAMPO DE TEXTO LIBRE A COMPLETAR EN RAEVET:Medicamento y breve descripción de la variación (por ejemplo: Nueva indicación, cambio del código ATCvet, cambio de titular, cambio del representante local, etc).
“Con fecha (día) de (mes) de (año) el titular (Titular de la Autorización) ha recibido la Decisión de la CE para la modificación de (motivo de la modificación) para el/los medicamento(s) (Nombre del medicamento).
En España dicha modificación afecta al (los) siguiente (s) formato (s) de dicho(s) medicamento(s):
Copia de la Información del medicamento en español emitida con la decisión de la Comisión (Anexos I-III), si el cambio afecta a dichos Anexos por ej. cambio de indicación)Formato 1 del medicamento / Nº de Registro Europeo / C.N.”
- En apoyo de esta notificación adjuntamos una Secuencia VNeeS incluyendo:
- Copia de la Decisión de la Comisión Europea para dicha variación.
- Copia de la versión vigente de los datos administrativos europeos (obtenida del expediente VNeeS del dossier europeo de registros para este medicamento, si el cambio afecta a los datos administrativos, por ej. cambio de código ATCvet)..
Con fecha (día) de (mes) de (año) el laboratorio (Titular de la Autorización) ha recibido la Decisión de la Comisión para la modificación de (motivo de la modificación) para el/los medicamento(s) (Nombre(s) del medicamento).
Con fecha (día) de (mes) de (año) el laboratorio (Titular de la Autorización) ha recibido la Decisión de la Comisión para la modificación de (motivo de la modificación) para el/los medicamento(s) (Nombre(s) del medicamento).
En España dicha modificación afecta a la(s) siguientes presentación(es) de dicho(s) medicamento(s):
- Presentación 1 del Medicamento / Nº de Registro Europeo / C.N.
En apoyo de esta notificación adjuntamos una Secuencia NEES incluyendo:
- Formato 1 del medicamento / Nº de Registro Europeo / C.N.”
- En apoyo de esta notificación adjuntamos una Secuencia VNeeS incluyendo:
- Copia de la Decisión de la Comisión Europea para dicha variación.
- Copia de la versión vigente de los datos administrativos europeos (obtenida del expediente VNeeS del dossier europeo de registros para este medicamento, si el cambio afecta a los datos administrativos, por ej. cambio de código ATCvet).
- Copia de la Información del medicamento en español emitida con la decisión de la Comisión (Anexos I-III), si el cambio afecta a dichos Anexos por ej. cambio de indicación).
Igualmente habrá que completar unos campos predeterminados en la citada pestaña de RAEVET II.
ANEXO 4. Instrucciones para los TAC y Representantes Locales en lo relativo a los permisos de inclusión de datos de RAEVET II.
La inclusión de datos en RAEVET II debe ser realizada por el TAC empleando medios propios o autorizando a un tercero.
Puede encontrar la información detallada sobre cómo realizar esta solicitud en la web de la AEMPS, sección Sede Electrónica .
(*) https://sinaem.aemps.es/WebComercializacion/login.aspx?opc=veterinaria
Si desea localizar información relacionada con el contenido de esta página, utilice el buscador

