Los medicamentos a base de alérgenos son un tipo de medicamentos inmunológicos destinado a detectar, provocar o tratar una alteración adquirida y específica en la respuesta inmunológica a un agente alergizante. Existen dos tipos:
- Medicamentos a base de alérgenos para inmunoterapia: medicamentos utilizados para modificar la respuesta anómala del sistema inmunitario induciendo una tolerancia al alérgeno en cuestión generando, por tanto, una menor reacción y síntomas de alergia.
- Medicamentos a base de alérgenos con finalidad diagnóstica in vivo: los que se utilizan para identificar las alergias por parte de profesionales sanitarios.
Algunos de estos medicamentos a base de alérgenos, tanto de uso humano como veterinarios, que, aunque de acuerdo con su régimen de producción podrían considerarse como medicamentos de fabricación industrial, por diversos motivos, generalmente ligados a la utilización del concepto de preparación individualizada y al hecho de que parte del proceso productivo no sea industrial, no cuentan con la autorización de comercialización de medicamentos propia de los medicamentos fabricados industrialmente.
Asimismo, debido a sus características específicas, alguno de los medicamentos a base de alérgenos pueden tener un régimen mixto, de producción industrial en fases tempranas y de acondicionamiento individual en fases tardías.
Seis meses después de la finalización del periodo de notificación establecido conforme a la Orden Ministerial SND/778/2023, de 10 de julio, por la que se regulan determinados aspectos de la autorización de los medicamentos a base de alérgenos de producción industrial y de los graneles de medicamentos a base de alérgenos de uso humano y veterinarios, la AEMPS publica una resolución vinculante en la que se incluye la relación de medicamentos a base de alérgenos de producción industrial y de los graneles de medicamentos a base de alérgenos de uso humano y veterinarios que han sido comunicados.
Además, en dicha resolución se fija un calendario para que los titulares de los citados medicamentos soliciten la correspondiente autorización de comercialización de acuerdo con lo establecido en el capítulo II del Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente, o el registro simplificado especial de acuerdo con lo establecido en el capítulo II del Real Decreto 1157/2021, de 28 de diciembre, por el que se regulan los medicamentos veterinarios fabricados industrialmente.
Este calendario, que se divide en 5 periodos, marca el tiempo máximo del que dispondrán los titulares para presentar las solicitudes de autorización o de registro simplificado especial, según corresponda. Los medicamentos a base de alérgenos cuya solicitud no haya sido presentada deberán dejar de comercializarse, no pudiéndose poner nuevos lotes de medicamento en el mercado a partir de dicha fecha. Los productos destinados al diagnóstico de alergias de contacto o Tipo IV podrán presentar el expediente de registro en cualquier momento dentro del periodo comprendido entre el 1 de enero de 2025 y el 31 de diciembre de 2030.
Calendario de medicamentos a base de alérgenos de uso humano
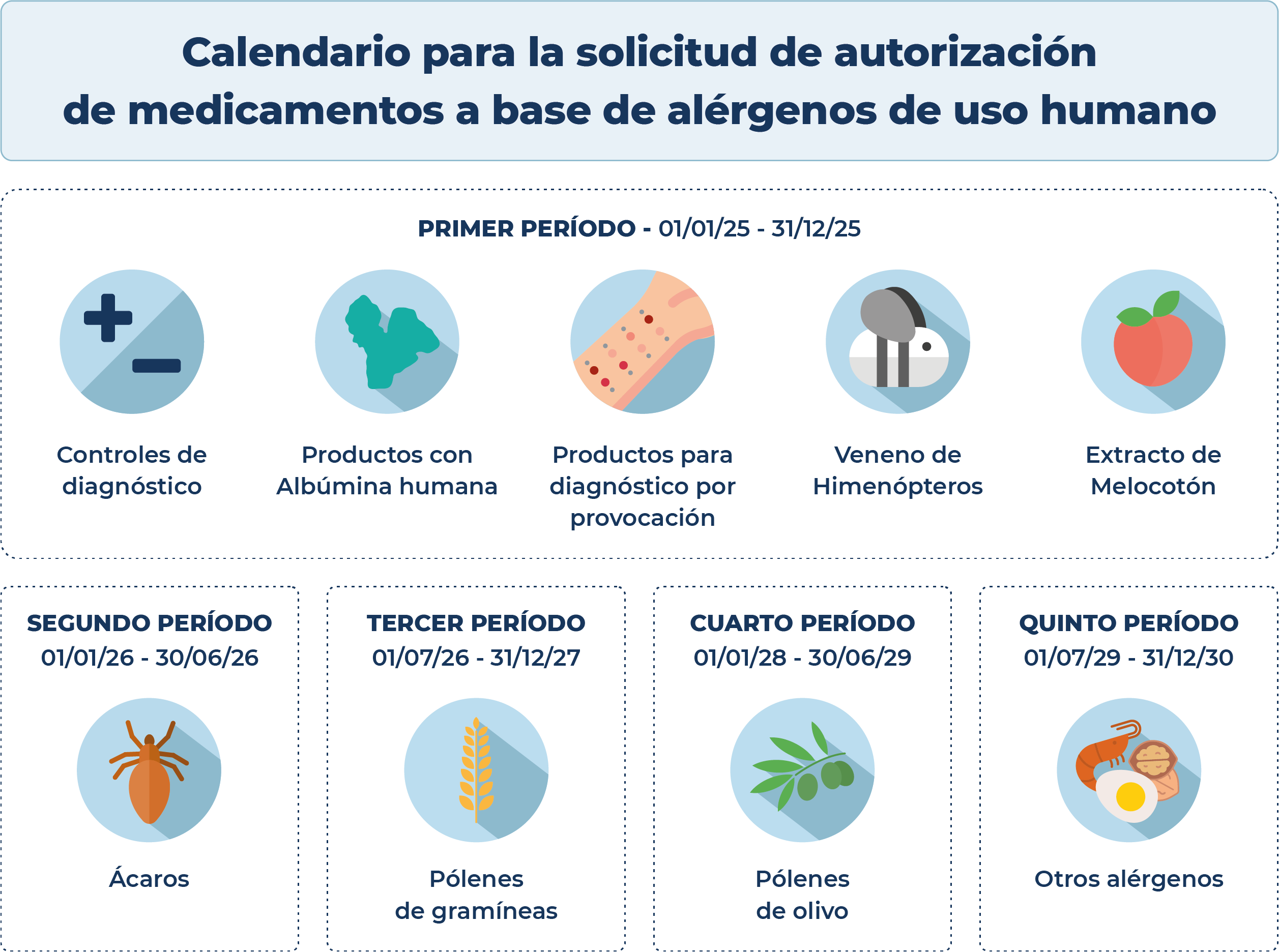
- Controles positivo y negativo de diagnósticos.
- Cualquier producto conteniendo albúmina humana en su composición.
- Productos para diagnóstico por provocación.
- Productos para diagnóstico, graneles e inmunoterapia que contengan veneno de himenópteros.
- Productos para diagnóstico, graneles e inmunoterapia que contengan extracto(s) de melocotón.
- Productos para diagnóstico, graneles e inmunoterapia que contengan extracto(s) de ácaros tanto individuales como formando parte de mezclas con otros extractos alergénicos.
- Productos para diagnóstico, graneles e inmunoterapia que contengan extracto(s) de pólenes de gramíneas tanto individuales como formando parte de mezclas con otros extractos alergénicos.
- Productos para diagnóstico, graneles e inmunoterapia que contengan extracto(s) de pólenes de olivo tanto individuales como formando parte de mezclas con otros extractos alergénicos
- Productos para diagnóstico, graneles e inmunoterapia que contengan extractos no incluidos en ninguno de los grupos anteriores
Calendario de medicamentos veterinarios a base de alérgenos
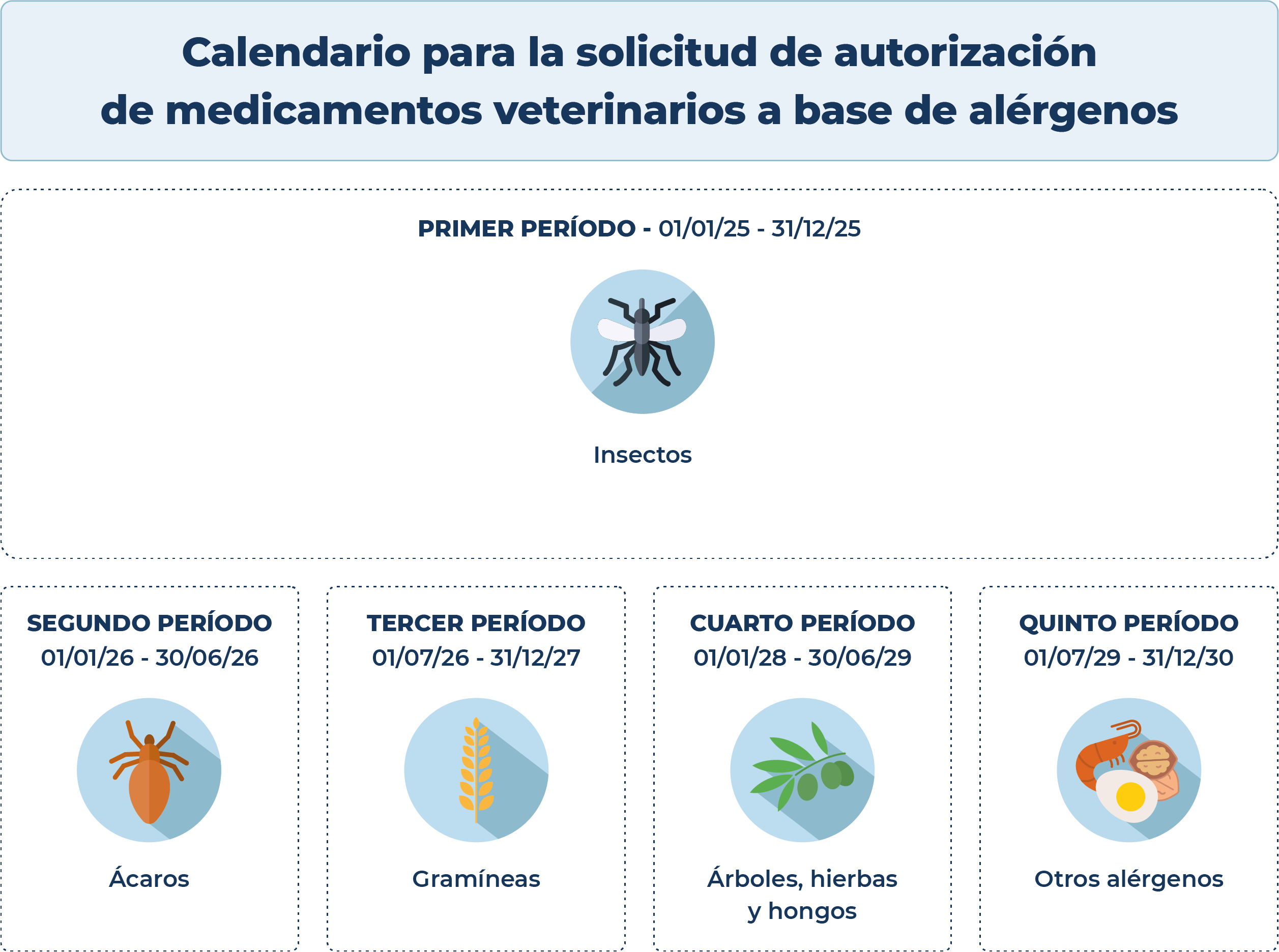
- Productos para diagnósticos, graneles e inmunoterapias que contengan insectos (culicoides, tábanos, blatella), individuales y mezclas que contengan únicamente insectos y controles positivo y negativo de diagnósticos
- Productos para diagnósticos, graneles e inmunoterapias que contengan ácaros, individuales y mezclas que contengan únicamente ácaros
- Productos para diagnósticos, graneles e inmunoterapias que contengan gramineas, individuales y mezclas que contengan únicamente gramíneas
- Productos para diagnósticos, graneles e inmunoterapias que contengan árboles hierbas y hongos, individuales y mezclas que contengan árboles, hierbas y hongos
- Resto de diagnósticos, graneles e inmunoterapias que no se encuentren incluidos en los periodos anteriores
Medicamentos y graneles autorizados o que dejarán de comercializarse / utilizarse
A medida que se vayan cumpliendo los períodos establecidos de presentación de solicitudes de autorización, se irán evaluando y añadiendo a las siguientes listas:
La lista de alérgenos que dejarán de comercializarse recogerá tanto los alérgenos que no hayan presentado la solicitud como aquellos para los que sí se ha presentado una solicitud de registro, pero se han denegado durante la evaluación, con la excepción indicada en la Orden Ministerial SND/778/2023.
Los alérgenos autorizados, por su condición de medicamentos autorizados se incluirán y podrán ser consultados en CIMA.
La lista de graneles que dejarán de utilizarse en la producción de medicamentos a base de alérgenos para inmunoterapia específica recogerá tanto los graneles que no hayan presentado la solicitud como aquellos para los que sí se ha presentado una solicitud de registro, pero se han denegado durante la evaluación, con la excepción indicada en la Orden Ministerial SND/778/2023.
La lista de graneles autorizados incluirá los graneles autorizados tras su evaluación. Por considerarse productos intermedios, no figurarán en CIMA.

