Introducción
La Agencia Española de Medicamentos y Productos Sanitarios publicó en 2013 una Resolución por la que se establecía la clasificación del uso terapéutico no sustitutivo del plasma autólogo y sus fracciones, componentes o derivados, como medicamento de uso humano para atender necesidades especiales. Junto a esta resolución, se publicó un informe sobre el uso de plasma rico en plaquetas (PRP). El objetivo de ambos fue establecer el marco de uso del PRP en España, así como las obligaciones que deben respetar sus fabricantes y la información mínima que deben recibir los pacientes a quienes se les aplique.
A lo largo de este tiempo, se han ido recibiendo consultas desde diferentes ámbitos que han hecho aconsejable la redacción de este documento de preguntas y respuestas en torno al uso terapéutico no sustitutivo de plasma autólogo y sus fracciones, componentes o derivados. Además, se considera necesario cerrar el registro de centros sanitarios.
La Agencia, en colaboración con todas las partes interesadas, seguirá revisando este documento que será actualizado conforme sea preciso.
Consideración del “plasma autólogo y sus fracciones, componentes o derivados” como medicamento
No. La clasificación del “plasma autólogo y sus fracciones, componentes o derivados” como medicamento de uso humano tiene que ver con el mecanismo de acción postulado así como a sus fines o indicaciones. Por lo tanto, el hecho de obtenerlo mediante una u otra técnica no cambia su consideración como medicamento de uso humano.
No. Las plaquetas, desde el punto de vista regulatorio, no se consideran como células. Es cierto que algunos preparados, englobados en la amplia definición de “plasma autólogo y sus fracciones, componentes o derivados”, pueden contener leucocitos. Sin embargo, en el mecanismo de acción propuesto para estos productos, estos leucocitos no suelen tener ningún papel o juegan, como mucho, un papel secundario.
No todas las sustancias activas que cumplen con la definición de medicamento de uso humano pueden producirse de manera industrial y, por lo tanto, estar sujetas a las mismas reglas que los medicamentos fabricados industrialmente. El artículo 5 de la Directiva 2001/83/CE, de 6 de noviembre, por la que se regulan los medicamentos en la Unión Europea ya establece que los Estados miembros pueden excluir de las disposiciones de la propia Directiva aquellos medicamentos elaborados de acuerdo con la prescripción de un facultativo reconocido y que los destine a un paciente individual bajo su responsabilidad personal directa. Es en el marco de este artículo 5 de la Directiva 2001/83/CE en el que la Agencia Española de Medicamentos y Productos Sanitarios ha clasificado el “plasma autólogo y sus fracciones, componentes o derivados” como un medicamento de uso humano pero no un medicamento de producción industrial.
La Resolución de 23 de mayo de 2013 de la Directora de la Agencia Española de Medicamentos y Productos Sanitarios solamente afecta al plasma autólogo. El uso terapéutico no sustitutivo de cualquier otro producto basado en plasma no autólogo recibiría el tratamiento de medicamento biológico susceptible de ser producido industrialmente y su autorización estaría regulada por el real decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente.
El colirio de suero autólogo se encuentra dentro de los productos de uso terapéutico no sustitutivo del “plasma autólogo y sus fracciones, componentes o derivados” y por lo tanto están regulados por los principios expuestos en la Resolución de 23 de mayo de 2013 de la Directora de la Agencia Española de Medicamentos y Productos Sanitarios y el informe que acompaña a dicha Resolución.
Garantías mínimas de calidad en la producción
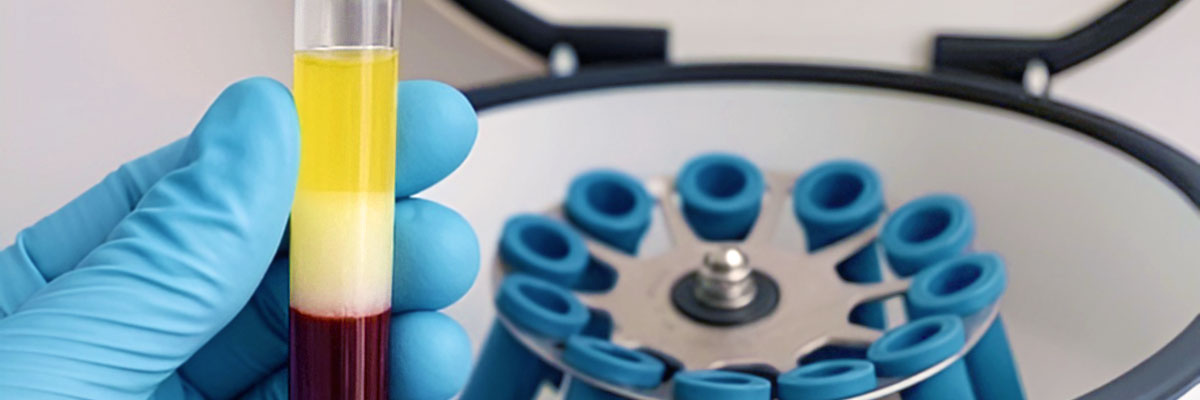
El informe que acompaña a la Resolución de 23 de mayo de 2013 considera como técnica cerrada los métodos de obtención de “plasma autólogo y sus fracciones, componentes o derivados” mediante kits desechables, siguiendo las instrucciones descritas en cada sistema comercial que deberá disponer de marcado CE otorgado para dicho uso.
En este contexto, el sistema cerrado es aquel que no permite que la muestra extraída del paciente tenga contacto con el exterior, mientras que el sistema abierto corresponde a aquel que no se considera cerrado.
La AEMPS ha iniciado un trabajo con un grupo de expertos de las Comunidades Autónomas y Sociedades Científicas en la elaboración de un listado positivo de sistemas que puedan ser catalogados como cerrados. Este listado será público y servirá de base para delimitar qué sistemas pueden ser considerados como cerrados, siendo considerados el resto, por defecto, como abiertos.
Sí, todos los productos sanitarios destinados a la obtención de “plasma autólogo y sus fracciones, componentes o derivados” deben incluir el marcado CE junto con el número de Organismo Notificado que ha evaluado su conformidad, independientemente del tipo de sistema utilizado.
El fabricante a través de la información proporcionada al usuario (etiquetado e instrucciones de uso), es quien determina el tipo de técnica específica para la que ha destinado su producto.
No, en España no se puede utilizar un producto sanitario que no tenga marcado CE a no ser que sea en una investigación clínica autorizada o que disponga de una autorización expresa de la AEMPS.
En principio, aquellos facultativos que utilicen técnicas cerradas no deben acreditar otro tipo de garantías relacionadas con la producción del “plasma autólogo y sus fracciones, componentes o derivados” más allá de las que les fueran exigidas en relación con el uso de acuerdo a las instrucciones de cada sistema comercial.
Ello no exime de los requisitos que deben cumplir en la elaboración de PRP mediante una técnica cerrada como son, entre otros, contar con personal e instalaciones adecuadas para la extracción de sangre y administración posterior del medicamento, contar con procedimientos normalizados de trabajo de higiene y vestimenta del personal, de limpieza y desinfección de las instalaciones, con PNT relativos al procedimiento de elaboración del PRP y del sistema de eliminación de residuos, y con registros de todas las actividades realizadas.
No, no resulta necesario.
Para importar un producto sanitario con marcado CE es necesario disponer de licencia de funcionamiento como importadores y que se realicen las notificaciones pertinentes (comunicación de comercialización y/o puesta en servicio). Además si el fabricante es de fuera de la Unión Europea, deberá tener un Representante Autorizado en Europa.
En estos casos, el método empleado deberá ser evaluado desde el punto de vista de calidad por parte de las autoridades competentes, las cuales deberán verificar la adecuación de las instalaciones y de las actividades de producción y de control de calidad efectuadas, tomando como referencia lo establecido en las Normas de Correcta Fabricación de la Unión Europea.
Las autoridades competentes de las Comunidades Autónomas y de la AEMPS han establecido unos criterios en el seno del Comité Técnico de Inspección que deben cumplir las instalaciones en las que se obtenga “plasma autólogo y sus fracciones, componentes o derivados” mediante técnica abierta.
Los productos utilizados en la realización de esta técnica que tengan la consideración de productos sanitarios, como por ejemplo productos para la transferencia de plasma, deberán disponer de marcado CE.
En este caso se deben cumplir las garantías de calidad y seguridad descritas para los sistemas abiertos.
Las inspecciones de instalaciones y la autorización de dichas instalaciones, son competencia de las Comunidades Autónomas, y en cada caso han establecido sus propios procedimientos. No existe una fecha límite para que las instalaciones estén acreditadas, pero sí la obligación por parte de éstas de cumplir las normas de calidad y seguridad suficientes. Por lo tanto, se deberá contactar con la autoridad autonómica competente para conocer el procedimiento de solicitud de inspección y autorización, y plazos correspondientes.
No. La elaboración y utilización en un mismo acto quirúrgico y en el entorno de un quirófano, se consideran adecuadas garantías de calidad y seguridad. A este respecto, se debe considerar que todo el procedimiento se realiza en un quirófano con características ambientales apropiadas, sin que ninguna fracción de la sangre de un paciente tenga que ser llevada a otro punto del hospital para ser procesada.
Únicamente aquellos laboratorios farmacéuticos que cuenten con autorización para realizar dicha actividad por la AEMPS, los bancos de sangre y centros de transfusiones con su sistema de calidad que garantice dicha elaboración.
Para que una empresa o entidad que no sea un centro sanitario pueda fabricar PRP para uso humano para terceros debe ser autorizado como laboratorio farmacéutico acorde a lo establecido en el artículo 5 del Real Decreto 824/2010, de 25 de junio, por el que se regulan los laboratorios farmacéuticos, los fabricantes de principios activos de uso farmacéutico y el comercio exterior de medicamentos y medicamentos en investigación.
Garantías de eficacia
No, todavía no se ha elaborado. Actualmente están en marcha varios ensayos clínicos que pueden ayudar a determinar la eficacia del “plasma autólogo y sus fracciones, componentes o derivados”.
Al no tratarse de un producto de fabricación industrial, no existe una ficha técnica del producto. Es más, al tratarse de diferentes tipos de productos, esta información podría depender del producto administrado. Es responsabilidad del facultativo prescriptor conocer qué producto está utilizando y ofrecer información al paciente de los posibles riesgos asociados al tratamiento.
Pruebas analíticas
Los productos derivados de la sangre tienen la potencialidad de transmitir diferentes enfermedades infecciosas. El médico prescriptor de un producto de estas características tiene que adoptar las medidas precisas de control, vigilancia y trazabilidad que impidan la transmisión de enfermedades infecciosas. El propio artículo 5 de la Directiva 2001/83/CE, de 6 de noviembre, enmarca este tipo de usos de acuerdo con la prescripción de un facultativo reconocido, para un paciente individual y bajo su responsabilidad personal directa.
Al tratarse de un uso autólogo, el riesgo de transmisión de enfermedad al propio sujeto depende esencialmente de la utilización de una técnica “limpia”. Sin embargo, es necesario considerar que, además de asegurar la calidad y la trazabilidad del producto utilizado, el conocimiento del estado serológico de un paciente puede contribuir a garantizar la seguridad del personal que participa en la fabricación y, eventualmente, servir como defensa al propio facultativo responsable en el caso de seroconversión tras un procedimiento autólogo. Finalmente, podría ser de interés en determinadas indicaciones conocer si el producto utilizado contiene ciertos virus a la hora de decidir la conveniencia o no de aplicar este tratamiento.
Por todo ello, se debe tomar como norma de referencia las directrices genéricas ya desarrolladas para otras substancies de origen humano para uso clínico recogidas en el capítulo 29 de la 3ª edición de la Guía del Consejo de Europa sobre Calidad y Seguridad de Tejidos y Células para aplicación humana.
Son relevantes en el caso del uso terapéutico no sustitutivo del “plasma autólogo y sus fracciones, componentes o derivados” las relativas a la detección de agentes infecciosos.
Si, se pueden utilizar productos sanitarios para diagnóstico in vitro de uso profesional siempre y cuando se encuentren comercializados en España cumpliendo los requisitos legales que les resulten de aplicación y no deben comprometer la salud ni la seguridad de los pacientes, usuarios o terceras personas y cuenten con marcado CE en su etiquetado.
Es muy importante tener en cuenta las instrucciones de uso que acompañan al producto para garantizar que la toma de muestra es correcta y seguir paso por paso el procedimiento descrito, así como las instrucciones para la interpretación de los resultados.
Publicidad
No, no se puede hacer publicidad dirigida al público en general. Aplican las mismas normas que al resto de los medicamentos. Sin embargo, informar sobre la cartera de servicios de los centros sí es posible aunque sin hacer publicidad de las técnicas. En todo caso, deberá cumplirse lo establecido en materia de publicidad de medicamentos en la normativa estatal y autonómica.