Índice
1. Medicamentos veterinarios de nuevo registro
En el presente apartado se recogen los medicamentos veterinarios de nuevo registro aprobados por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) considerados de mayor interés para los profesionales sanitarios. La concesión de la autorización supone el derecho del titular a poder comercializar el medicamento, pero no significa que en estos momentos el producto se encuentre ya en el mercado.
La información completa de cada uno de ellos (incluida su Ficha Técnica) se podrá consultar en la Web de la AEMPS, dentro de la sección “Medicamentos veterinarios autorizados”.
-
VECTORMUNE FP ILT + AE liofilizado y disolvente para suspensión inyectable para pollos. (EU/2/20/250/001-006)
- Nombre de la/s sustancias activas: Virus vivo recombinante de la viruela aviar, que expresa la proteína de fusión de membrana y la proteína de encapsidación del virus de la laringotraqueítis infecciosa aviar (rFP-LT) y Virus de la encefalomielitis aviar, cepa Calnek 1143 (AE).
-
Indicaciones de uso: Para la inmunización activa de pollos de 8 a 13 semanas de edad para reducir las lesiones cutáneas debidas a la viruela aviar, para reducir los síntomas clínicos y las lesiones traqueales debidas a la laringotraqueítis infecciosa aviar y para prevenir las caídas de puesta debidas a la encefalomielitis aviar.
Establecimiento de la inmunidad:
Viruela aviar y laringotraqueítis infecciosa aviar: 3 semanas después de la vacunación.
Encefalomielitis aviar: 20 semanas después de la vacunación.Duración de la inmunidad:
Viruela aviar: 34 semanas después de la vacunación.
Laringotraqueítis infecciosa aviar y encefalomielitis aviar: 57 semanas después de la vacunación. - Especies de destino: Pollos.
- Tiempos de espera: Cero días.
-
Reacciones adversas: Pueden aparecer pequeñas inflamaciones y costras típicas de la respuesta a la vacunación de viruela muy frecuentemente, que deben desaparecer en los 14 días posteriores a la vacunación.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
-
Prescripción: Medicamento sujeto a prescripción veterinaria.
En virtud del artículo 71 de la Directiva 2001/82/CE del Parlamento Europeo y del Consejo modificada, un Estado Miembro puede, de conformidad con su legislación nacional, prohibir la fabricación, importación, posesión, venta, suministro y/o uso de los medicamentos veterinarios inmunológicos en la totalidad o en parte de su territorio, si se demostrase que:
- La administración del medicamento a animales interfiere con la aplicación de un programa nacional para el diagnóstico, el control o la erradicación de enfermedades de los animales, o dificulta la certificación de ausencia de contaminación en animales vivos o en alimentos u otros productos obtenidos de animales tratados.
- El medicamento veterinario está destinado a inducir inmunidad frente a una enfermedad ausente desde hace mucho tiempo en el territorio en cuestión.
-
TULAVEN 100 mg/ml solución inyectable para bovino, porcino y ovino. (EU/2/20/251/001-005)
- Nombre de la/s sustancias activas: Tulatromicina.
-
Indicaciones de uso:
Bovino: Tratamiento y metafilaxis de la enfermedad respiratoria bovina (ERB) asociada con Mannheimia haemolytica, Pasteurella multocida, Histophilus somni y Mycoplasma bovis sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico.
Tratamiento de la queratoconjuntivitis infecciosa bovina (QIB) asociada con Moraxella bovis sensible a la tulatromicina.
Porcino: Tratamiento y metafilaxis de enfermedades respiratorias de porcino (ERP) asociadas con Actinobacillus pleuropneumoniae, Pasteurella multocida, Mycoplasma hyopneumoniae, Haemophilus parasuis y Bordetella bronchiseptica sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico. El medicamento veterinario solo debe usarse si se espera que los cerdos desarrollen la enfermedad en el plazo de 2-3 días.
Ovino:Tratamiento de las primeras etapas de pododermatitis infecciosa (pedero) asociado con Dichelobacter nodosus virulento que requiere tratamiento sistémico.
- Especies de destino: Bovino, porcino y ovino.
-
Tiempos de espera:
Bovino (carne): 22 días.
Porcino (carne): 13 días.
Ovino (carne): 16 días. -
Reacciones adversas: La administración subcutánea en bovino de este medicamento veterinario causa dolor pasajero e inflamaciones locales en el punto de inyección muy frecuentemente, que pueden persistir hasta 30 días. No se han observado dichas reacciones en porcino y ovino después de la administración intramuscular.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
TULAVEN 25 mg/ml solución inyectable para porcino (EU/2/20/251/006-008)
- Nombre de la/s sustancias activas: Tulatromicina.
- Indicaciones de uso: Tratamiento y metafilaxis de las enfermedades respiratorias de porcino (ERP) asociadas con Actinobacillus pleuropneumoniae, Pasteurella multocida, Mycoplasma hyopneumoniae, Haemophilus parasuis y Bordetella bronchiseptica sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico. El medicamento veterinario solo debe usarse si se espera que los cerdos desarrollen la enfermedad en el plazo de 2-3 días.
- Especies de destino: Porcino.
- Tiempos de espera: 13 días.
-
Reacciones adversas: Las reacciones patomorfológicas en el punto de inyección (incluyendo cambios reversibles de congestión, edema, fibrosis y hemorragia) están presentes aproximadamente 30 días después de la inyección.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
TULISSIN 100 mg/ml solución inyectable para bovino, porcino y ovino. (EU/2/20/252/001-007)
- Nombre de la/s sustancias activas: Tulatromicina.
-
Indicaciones de uso:
Bovino: Tratamiento y metafilaxis de la enfermedad respiratoria bovina (ERB) asociada con Mannheimia haemolytica, Pasteurella multocida, Histophilus somni y Mycoplasma bovis sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico.
Tratamiento de la queratoconjuntivitis infecciosa bovina (QIB) asociada con Moraxella bovis sensible a la tulatromicina.
Porcino: Tratamiento y metafilaxis de enfermedades respiratorias de porcino (ERP) asociadas con Actinobacillus pleuropneumoniae, Pasteurella multocida, Mycoplasma hyopneumoniae, Haemophilus parasuis y Bordetella bronchiseptica sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico. El medicamento veterinario solo debe usarse si se espera que los cerdos desarrollen la enfermedad en el plazo de 2-3 días.
Ovino:Tratamiento de las primeras etapas de pododermatitis infecciosa (pedero) asociado con Dichelobacter nodosus virulento que requiere tratamiento sistémico.
- Especies de destino: Bovino, porcino y ovino.
-
Tiempos de espera:
Bovino (carne): 22 días.
Porcino (carne): 13 días.
Ovino (carne): 16 días. -
Reacciones adversas: La administración subcutánea en bovino de este medicamento veterinario causa dolor pasajero e inflamaciones locales en el punto de inyección muy frecuentemente, que pueden persistir hasta 30 días. No se han observado dichas reacciones en porcino y ovino después de la administración intramuscular.
Las reacciones patomorfológicas en el punto de inyección (incluyendo cambios reversibles de congestión, edema, fibrosis y hemorragia) se observan muy frecuentemente, aproximadamente, 30 días después de la inyección en bovino y porcino.
En ovino, la aparición de signos transitorios de molestia (sacudidas de cabeza, fricción del lugar de inyección, caminar hacia atrás) se observa muy frecuentemente después de la administración intramuscular. Estos signos remiten en pocos minutos.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
TULISSIN 25 mg/ml solución inyectable para porcino (EU/2/20/252/008-012)
- Nombre de la/s sustancias activas: Tulatromicina.
- Indicaciones de uso: Tratamiento y metafilaxis de las enfermedades respiratorias de porcino (ERP) asociadas con Actinobacillus pleuropneumoniae, Pasteurella multocida, Mycoplasma hyopneumoniae, Haemophilus parasuis y Bordetella bronchiseptica sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico. El medicamento veterinario solo debe usarse si se espera que los cerdos desarrollen la enfermedad en el plazo de 2-3 días.
- Especies de destino: Porcino.
- Tiempos de espera: Carne: 13 días.
-
Reacciones adversas: Las reacciones patomorfológicas en el punto de inyección (incluyendo cambios reversibles de congestión, edema, fibrosis y hemorragia) están presentes aproximadamente 30 días después de la inyección.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
LYDAXX 100 mg/ml solución inyectable para bovino, porcino y ovino (EU/2/20/253/001-004)
- Nombre de la/s sustancias activas: Tulatromicina.
-
Indicaciones de uso:
Bovino: Tratamiento y metafilaxis de la enfermedad respiratoria bovina (ERB) asociada con Mannheimia haemolytica, Pasteurella multocida, Histophilus somni y Mycoplasma bovis sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico.
Tratamiento de la queratoconjuntivitis infecciosa bovina (QIB) asociada con Moraxella bovis sensible a la tulatromicina.
Porcino: Tratamiento y metafilaxis de enfermedades respiratorias de porcino (ERP) asociadas con Actinobacillus pleuropneumoniae, Pasteurella multocida, Mycoplasma hyopneumoniae, Haemophilus parasuis y Bordetella bronchiseptica sensibles a la tulatromicina. Debe establecerse la presencia de la enfermedad en el rebaño antes del tratamiento metafiláctico. El medicamento veterinario solo debe usarse si se espera que los cerdos desarrollen la enfermedad en el plazo de 2-3 días.
Ovino: Tratamiento de las primeras etapas de pododermatitis infecciosa (pedero) asociado con Dichelobacter nodosus virulento que requiere tratamiento sistémico. Especies de destino: Bovino, porcino y ovino.
- Especies de destino: Bovino, porcino y ovino.
-
Tiempos de espera:
Bovino (carne): 22 días.
Porcino (carne): 13 días.
Ovino (carne): 16 días. -
Reacciones adversas: La administración subcutánea del medicamento veterinario en bovino causa dolor pasajero e inflamaciones locales en el punto de inyección muy frecuentemente, que pueden persistir hasta 30 días. No se han observado dichas reacciones en porcino y ovino después de la administración intramuscular.
Las reacciones patomorfológicas en el punto de inyección (incluyendo cambios reversibles de congestión, edema, fibrosis y hemorragia) se observan muy frecuentemente, aproximadamente, 30 días después de la inyección en bovino y porcino.
En ovino, la aparición de signos transitorios de molestia (sacudidas de cabeza, fricción del lugar de inyección, caminar hacia atrás) se observa muy frecuentemente después de la administración intramuscular. Estos signos remiten en pocos minutos.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
AVISHIELD IB GI-13 liofilizado para suspensión oculonasal y para administración en agua de bebida para pollos (3882 ESP)
- Nombre de la/s sustancias activas: Virus vivo de la bronquitis infecciosa aviar, variante de la cepa V-173/11.
-
Indicaciones de uso: Inmunización activa de pollos (pollos de engorde y pollitas futuras ponedoras/reproductoras) para reducir los efectos nocivos derivados de la infección por el virus de la bronquitis infecciosa aviar, serotipo 793B (linaje GI-13), sobre la actividad ciliar, que puede manifestarse mediante signos clínicos respiratorios.
Inicio de la inmunidad: 10 días tras la vacunación.
Duración de la inmunidad: 56 días tras la vacunación.
- Especies de destino: Pollos.
- Tiempos de espera: Cero días.
-
Reacciones adversas: Muy frecuentemente se han observado estertores traqueales entre 1 y 13 días después de la vacunación por vía oculonasal. En caso de producirse, remiten espontáneamente y no requieren tratamiento.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
NOBILIS SALENVAC ETC suspensión inyectable para pollos (3883 ESP)
-
Nombre de la/s sustancias activas:
Salmonella Enteritidis cepa PT4 inactivada
Salmonella Typhimurium cepa DT104 inactivada
Salmonella Infantis cepa A S03499-06 inactivada -
Indicaciones de uso: Para la inmunización activa de pollos a partir de las 6 semanas de edad para reducir la colonización y excreción fecal de S. Enteritidis (serogrupo D), S. Typhimurium y S. Heidelberg (serogrupo B), S. Infantis, S. Hadar y S. Virchow (serogrupo C).
Establecimiento de la inmunidad después de la segunda vacunación:
- S. Enteritidis, S. Typhimurium, S. Infantis, S. Hadar y S. Virchow: 4 semanas.
- S. Heidelberg: 9 semanas*.
*Primer punto de tiempo investigado.
Duración de la inmunidad después de la segunda vacunación:
- S. Enteritidis: 48 semanas (demostrada por desafío) y 90 semanas (demostrada por serología).
- S. Typhimurium: 57 semanas (demostrada por desafío) y 90 semanas (demostrada por serología).
- S. Infantis: 51 semanas (demostrada por desafío).
- S. Hadar: 51 semanas (demostrada por desafío).
- S. Virchow: 51 semanas (concluida de razonamiento científico).
- S. Heidelberg: 57 semanas (concluida de razonamiento científico).
- Especies de destino: Pollos reproductores y gallinas ponedoras.
- Tiempos de espera: Cero días.
-
Reacciones adversas: La vacunación puede dar lugar a nódulos palpables en el punto de inyección, pequeños (de un tamaño de hasta 8 mm) y transitorios, muy frecuentemente. Estos nódulos desaparecen completamente dentro de las 2 semanas siguientes a la segunda vacunación.
La vacunación puede estar asociada a efectos sistémicos leves y transitorios, como una reducción de la actividad y de la ingesta de alimento que dura hasta 2 días después de la primera vacunación, muy frecuentemente.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
-
OPTOMEASE 200mg/ml concentrado para solución para tratamiento de peces (3885 ESP)
- Nombre de la/s sustancias activas: Benzocaína.
-
Indicaciones de uso: Anestesia y sedación de salmón y trucha.
Este medicamento veterinario no debe usarse en aguas abiertas y se debe usar siempre en un recipiente de tratamiento aislado.
- Especies de destino: Salmón del Atlántico y trucha arco iris.
-
Tiempos de espera: Carne: 7 grados-día.
Su uso no está autorizado en peces durante el proceso de extracción de los huevos destinados para consumo humano.
- Reacciones adversas: Ninguna conocida.
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
API-BIOXAL 886 mg/g polvo para uso en colmenas (nº reg 3886 ESP)
- Nombre de la/s sustancias activas: Ácido oxálico dihidrato.
- Indicaciones de uso: Tratamiento de la varroasis (Varroa destructor, parasito de Apis mellifera).
- Especies de destino: Abejas.
-
Tiempos de espera: Cero días.
No tratar las colmenas con las alzas colocadas o durante la producción de miel.
- Reacciones adversas: La colonia puede agitarse ligeramente durante el tratamiento. Se puede observar una mayor mortalidad de las abejas adultas después del tratamiento con el medicamento veterinario.
- Prescripción: Medicamento sujeto a prescripción veterinaria.
-
PORVAXIN M.HYO emulsión inyectable para porcino (3901 ESP)
- Nombre de la/s sustancias activas: Mycoplasma hyopneumoniae, inactivado, cepa 1137/99.
-
Indicaciones de uso: Inmunización activa de cerdos de engorde para reducir la gravedad de las lesiones pulmonares en animales con presencia probada de Mycoplasma hyopneumoniae.
Establecimiento de la inmunidad: 14 días (independientemente del calendario de vacunación utilizado).
Duración de la inmunidad: 26 semanas.
- Especies de destino: Lechones.
- Tiempos de espera: Cero días.
-
Reacciones adversas: Tras la aplicación puede desarrollarse una reacción local común de hasta 3 cm de diámetro, que desaparecerá espontáneamente en 3 días.
Es frecuente un aumento transitorio de la temperatura corporal en los animales tratados (máximo 1ºC).
Muy frecuentemente puede producirse temblor, letargo leve y somnolencia después de la aplicación que desaparecen espontáneamente en varias horas.
En raras ocasiones puede desarrollarse una reacción de hipersensibilidad. En tal caso hay que empezar inmediatamente un tratamiento adecuado.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
- Prescripción: Medicamento sujeto a prescripción veterinaria.
2. Cambios de especial interés sanitario en medicamentos ya autorizados
En el presente apartado se recogen las variaciones de las autorizaciones de medicamentos veterinarios aprobadas por la AEMPS consideradas de mayor interés para los profesionales sanitarios. La concesión de la variación de la autorización significa que el titular solamente podrá poner en el mercado a partir de esa fecha lotes del medicamento de conformidad con dicha variación. Es posible por tanto que puedan coincidir en el mercado lotes anteriores y posteriores a la variación autorizada.
La Ficha Técnica completa se puede consultar en la Web de la AEMPS, dentro de la sección “Medicamentos veterinarios autorizados”.
Nuevas indicaciones con dictamen positivo para su autorización.
- FRONTLINE TRI-ACT solución spot-on para perros 2-5 kg (3089 ESP)
- FRONTLINE TRI-ACT solución spot-on para perros 5-10 kg (3090 ESP)
- FRONTLINE TRI-ACT solución spot-on para perros 10-20 kg (3091 ESP)
- FRONTLINE TRI-ACT solución spot-on para perros 20-40 kg (3092 ESP)
-
FRONTLINE TRI-ACT solución spot-on para perros 40-60 kg (3093 ESP)
- Nombre de la sustancia activa: Fipronilo y permetrina.
-
Indicaciones: “En perros: Para el tratamiento y prevención de infestaciones por pulgas y/o garrapatas cuando sea necesario una actividad repelente (anti-alimentación) contra flebotomos, moscas picadoras y/o mosquitos.
Pulgas: Tratamiento y prevención de las infestaciones por pulgas Ctenocephalides felis y prevención de las infestaciones por pulgas Ctenocephalides canis. Un tratamiento previene una nueva infestación por pulgas durante 4 semanas.
El medicamento veterinario puede utilizarse como parte de la estrategia de tratamiento de la dermatitis alérgica por picadura de pulgas, cuando haya sido previamente diagnosticada por un veterinario.
Garrapatas: Tratamiento y prevención de las infestaciones por garrapatas (Dermacentor reticulatus, Ixodes ricinus, Rhipicephalus sanguineus ). Un tratamiento mata las garrapatas (Dermacentor reticulatus, Ixodes ricinus, Rhipicephalus sanguineus), repele las garrapatas (Ixodes ricinus, Rhipicephalus sanguineus) durante 4 semanas después del tratamiento, y repele las garrapatas Dermacentor reticulatus desde los 7 días hasta las 4 semanas después del tratamiento.
Mosquitos y flebótomos: Repele (actividad anti-alimentación) flebotomos (Phlebotomus perniciosus) durante 3 semanas y mosquitos (Culex pipiens, Aedes albopictus) durante 4 semanas.
Mata flebotomos (Phlebotomus perniciosus) y mosquitos (Aedes albopictus) durante 3 semanas.
Reducción del riesgo de infección por Leishmania infantum a través de la transmisión por flebotomos (Phlebotomus perniciosus) durante un periodo de hasta 4 semanas. El efecto es indirecto debido a la actividad del medicamento veterinario contra el vector.
Mosca de los establos: Repele (actividad anti-alimentación) y mata la mosca de los establos (Stomoxys calcitrans) durante 5 semanas.
3. Información sobre seguridad
La Ficha Técnica completa se puede consultar en la Web de la AEMPS, dentro de la sección “Medicamentos veterinarios autorizados”.
-
PORCILIS PRRS liofilizado y disolvente para suspensión inyectable para porcino (1361 ESP)
- Nombre de las sustancias activas: Virus PRRS cepa DV vivo atenuado.
- El apartado “Interacción con otros medicamentos y otras formas de interacción” de la ficha técnica y del prospecto ha cambiado a:” Existe información sobre la seguridad y la eficacia de la inyección intramuscular en cerdos de cebo a partir de 4 semanas, que demuestra que esta vacuna puede mezclarse con Porcilis M Hyo. Antes de la administración de los medicamentos mezclados, debería consultarse el prospecto de Porcilis M Hyo. No existe información sobre la seguridad y la eficacia del uso de Porcilis PRRS mezclado con Porcilis M Hyo en animales reproductores o durante la gestación. Además, existe información sobre la seguridad y la eficacia, para ambas vías de administración, en cerdos de cebo a partir de las 3 semanas de edad, que demuestra que esta vacuna se puede administrar con Porcilis PCV M Hyo, con Porcilis Lawsonia, o con una mezcla de Porcilis PCV M Hyo y Porcilis Lawsonia,al mismo tiempo, pero en lugares separados (preferiblemente en el lado opuesto del cuello). Antes de la administración, debería consultarse el prospecto de Porcilis PCV M Hyo y/o Porcilis Lawsonia. En cerdos individuales, el aumento de temperatura después del uso asociado puede exceder frecuentemente de 2 °C. La temperatura vuelve a la normalidad entre 1 y 2 días después de observarse el máximo de temperatura. Frecuentemente, tras la vacunación intradérmica y la intramuscular, a partir de 5 días después de la vacunación, pueden aparecer reacciones locales transitorias en el lugar de inyección, que se limitan a una ligera inflamación (máximo 2 cm de diámetro). Estas reacciones pueden persistir ocasionalmente hasta 29 días o más después de la vacunación.Infrecuentemente pueden aparecer reacciones de hipersensibilidad después de la vacunación. No existe información sobre la seguridad y la eficacia de la administración de Porcilis PRRS en asociación con Porcilis PCV M Hyo y/o Porcilis Lawsonia, al mismo tiempo en lugares separados, en animales reproductores o durante la gestación. No existe información disponible sobre la seguridad y la eficacia del uso de esta vacuna con cualquier otro medicamento veterinario excepto los medicamentos mencionados anteriormente. La decisión sobre el uso de esta vacuna antes o después de la administración de cualquier otro medicamento veterinario se deberá realizar caso por caso.”
-
PORCILIS LAWSONIA (3814 ESP)
- Nombre de las sustancias activas: Lawsonia intracellularis cepa SPAH-08 inactivada.
- El apartado “Interacción con otros medicamentos y otras formas de interacción” de la ficha técnica y del prospecto ha cambiado a: Existe información sobre la seguridad y la eficacia en cerdos a partir de las 3 semanas de edad, que demuestra que esta vacuna se puede administrar al mismo tiempo que Porcilis PCV M Hyo y/o Porcilis PRRS. Cuando se administra Porcilis Lawsonia al mismo tiempo que Porcilis PCV M Hyo, estos medicamentos deberían mezclarse (ver sección 4.9 a continuación), mientras que Porcilis PPRS siempre debería administrarse en un lugar separado (preferiblemente en el lado opuesto del cuello). Antes de la administración, debería consultarse el prospecto de Porcilis PCV M Hyo y/o Porcilis PRRS. En cerdos individuales, el aumento de temperatura después del uso asociado puede exceder frecuentemente de 2 °C. La temperatura vuelve a la normalidad entre 1 y 2 días después de observarse el máximo de temperatura. Frecuentemente pueden aparecer reacciones locales transitorias en el lugar de inyección, que se limitan a una ligera inflamación (máximo 2 cm de diámetro), justo después de la vacunación, pero estas reacciones pueden no aparecer hasta 12 días después de la vacunación. Todas estas reacciones remitirán en 6 días. Pueden producirse reacciones de hipersensibilidad después de la vacunación infrecuentemente. No existe información disponible sobre la seguridad y la eficacia del uso de esta vacuna con cualquier otro medicamento veterinario excepto los medicamentos mencionados anteriormente. La decisión sobre el uso de esta vacuna antes o después de la administración de cualquier otro medicamento veterinario se deberá realizar caso por caso.
-
PROPOFOL LIPURO 10 mg/ml emulsión inyectable Braun uso veterinario (1578 ESP)
- Nombre de las sustancias activas: Propofol.
- En el apartado 4.6 de la Ficha Técnica y en el apartado 6 del prospecto se incluye el signo diarrea en la siguiente frase: “Durante la fase de recuperación puede presentarse diarrea y vómitos”
-
FILAVAC VHD K C+V suspensión (3535 ESP)
- Nombre de las sustancias activas: Virus de la enfermedad hemorragica del conejo tipo 2 (rhdv2) inactivado, cepa lp.sv.2012; Virus de la enfermedad virica hemorragica del conejo (rhd), inactivado, cepa im.507.sc.2011.
-
En el apartado 4.6 se la Ficha Técnica y en el apartado 6 del prospecto se modifican las dos primeras frases, y se incluye la tabla de frecuencias:
Muy frecuentemente: se puede observar un aumento temporal de la temperatura corporal de hasta 1,6ºC un día después de la vacunación.
Muy frecuentemente: la inmunización puede ser seguida por una reacción local limitada (nódulo subcutáneo de hasta 10 mm de diámetro en el estudio de dosis doble) que puede ser palpable durante al menos 52 días y que desaparece sin tratamiento.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
-
SOLIPHEN 60 mg comprimidos para perros (3244 ESP)
- Nombre de las sustancias activas: Fenobarbital.
-
En el apartado 4.6 de la Ficha Técnica y en el apartado 6 del prospecto se añaden diarrea y emesis en la siguiente frase:
“Rara vez se ha informado de diarrea y emesis”.
-
CANITROID SABOR 200, 400, 600 y 800 microgramos comprimidos para perros (2473 ESP, 2474 ESP, 2475 ESP Y 2476 ESP)
- Nombre de las sustancias activas: Levotiroxina sódica.
-
En el apartado 4.6 de la Ficha técnica y en el apartado 6 del prospecto, se añade las reacciones de hiper-sensibilidad en la siguiente frase y se incluye la tabla de frecuencias:
“Muy raramente se han notificado reacciones de hipersensibilidad (prurito)”.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
- Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
- Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
- Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
- En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
- En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados)
-
SUPRELORIN 4,7 mg implante para perros (nº reg. EU/2/07/072/001-002) y SUPRELORIN 9,4 mg implante para perros y hurones (nº reg. EU/2/07/072/003-004)
- Nombre de las sustancias activas: Deslorelina.
-
En el apartado 4.6 de la Ficha técnica y en el apartado 6 del prospecto se añade:
Se observó una inflamación moderada en el lugar de implantación durante 14 días frecuentemente en los estudios de seguridad/eficacia.
Durante el periodo de tratamiento, se han reportado efectos clínicos raros: desórdenes en la capa de pelo (p.e pérdida de pelo, alopecia, modificación del pelo), incontinencia urinaria, baja regulación asociada a los síntomas (p.e disminución del tamaño testicular, reducción de la actividad, ganancia de peso). Un testículo podrá ascender por encima del anillo inguinal en muy raras ocasiones.
Ha habido incremento transitorio del interés sexual, incrementando el tamaño testicular y el dolor testicular inmediatamente después de la implantación en muy raras ocasiones. Estos síntomas se resolvieron sin tratamiento.
Se han reportado cambios transitorios en el comportamiento con el desarrollo de agresión en muy raras ocasiones (ver sección 4.4).
En seres humanos y animales, la testosterona modula la susceptibilidad a las convulsiones. Se ha reportado la aparición transitoria de convulsiones poco después de la implantación en muy raras ocasiones (<0,01%), aunque no se ha establecido la relación casual con la aplicación del implante. En algunos casos, el perro había mostrado una convulsión epiléptica antes de la administración del implante o había sido diagnosticado como que sufría de epilepsia.
-
En el apartado 9 de la Ficha técnica y del prospecto se inserta un pictograma para explicar de forma más clara el método de administración del implante:
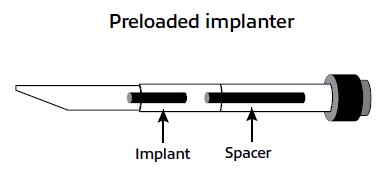
-
ADVOCATE 40mg + 4mg solución para unción dorsal puntual para perros pequeños (EU/2/03/039/005-6)
ADVOCATE 100mg + 25mg solución para unción dorsal puntual para perros medianos (EU/2/03/039/007-8)
ADVOCATE 250mg + 62,5mg solución para unción dorsal puntual para perros pequeños grandes (EU/2/03/039/009-10)
ADVOCATE 400mg + 100mg solución para unción dorsal puntual para perros pequeños muy grandes (EU/2/03/039/011-12)- Nombre de las sustancias activas: Imidacloprid + Moxidectina.
-
En el apartado 4.6 de la Ficha técnica y en el apartado 6 del prospecto, se añade la siguiente frase:
“Se han notificado reacciones locales de sensibilidad cutánea pasajera, que incluyen picor, pérdida de pelo, pelo grasiento y enrojecimiento en el lugar de aplicación en muy raras ocasiones a través de los informes espontáneos (farmacovigilancia)”.

